表观快讯 | Mol Cancer:超级增强子在干细胞中的研究

干细胞的特征,如增殖、自我更新、分化和再生,依赖于遗传或表观遗传因素的维持。超级增强子(SE)是近年来发现的一种重要的基因调控元件,它比普通增强子拥有更长的序列、更强的信号以及更高的转录因子(TF)密度。SE由活性增强子簇组成,通过特定的转录模式在维持干细胞特性中发挥关键作用。SE引导的转录复合体,包括非编码RNA和主要的TF,形成相分离的凝聚体,调控干细胞命运。
正文:
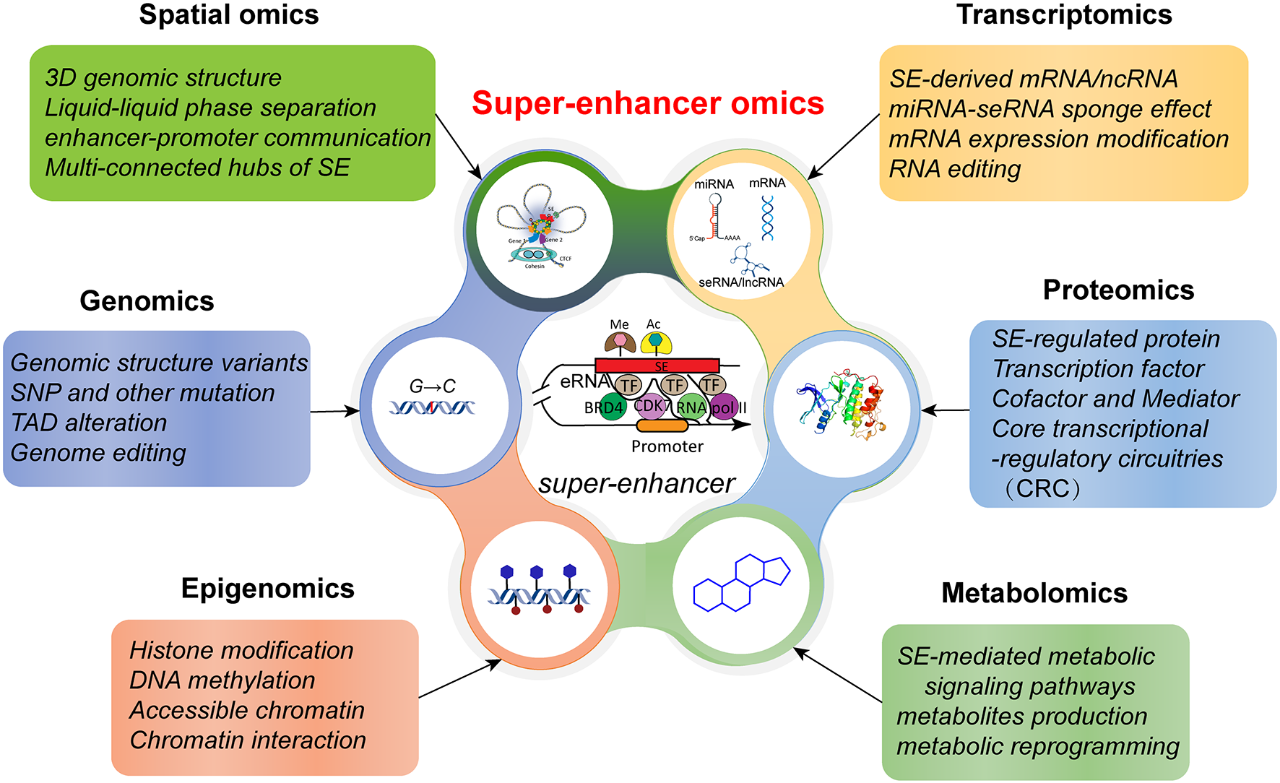
超级增强子组学示意图
研究发现,SE在干细胞命运决定中至关重要。多能性主控转录因子(如Oct4、Sox2、Nanog)能够特异性地结合SE,并招募Mediator复合物、共激活因子以及染色质重塑酶,形成一个高效的转录调控平台。这些转录调控复合物能够改变超级增强子域(SED)的组蛋白修饰状态,促进染色质开放,并最终激活干细胞特性相关基因的表达。此外,SE还能够调控非编码RNA(ncRNA)的表达,例如增强子RNA(eRNA)、超级增强子RNA(seRNA)和长链非编码RNA(lncRNA)。这些非编码RNA能够通过多种机制,例如竞争性内源RNA(ceRNA)网络、染色质重塑、转录因子招募等,参与超级增强子的调控,进而影响干细胞的命运决定。
为了鉴定基因组中的增强子,采用高通量测序技术,如ChIP-seq,识别富含H3K27ac和H3K4me1的活性增强子。CUT&Tag可以鉴定DNA结合蛋白在基因组上的结合位置,包括增强子区域。ATAC-seq、DNase-seq等用于检测开放染色质。其他测序技术如3C、4C和5C、Hi-C等,用于揭示增强子与其他调控元素的互作。此外,GRO-seq和STARR-seq等技术有助于识别增强子位置。

a)典型增强子和SE协同性的示意图;b)液相分离模型中SE和SED的结构;c)SE驱动的核心调控回路
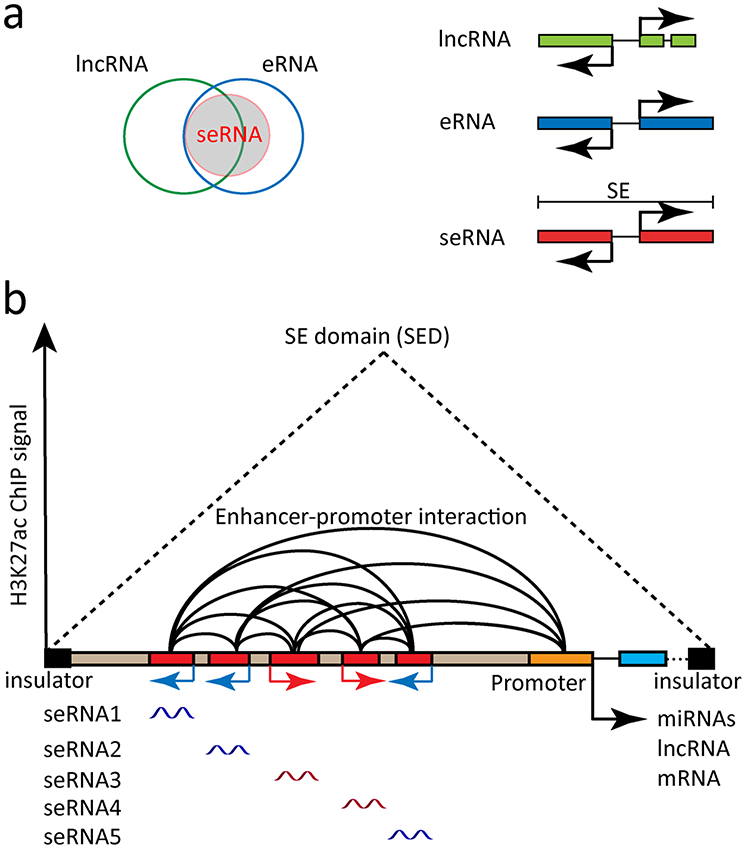
a)seRNA、eRNA和lncRNA的关系;b)SE中转录的seRNA示意图;
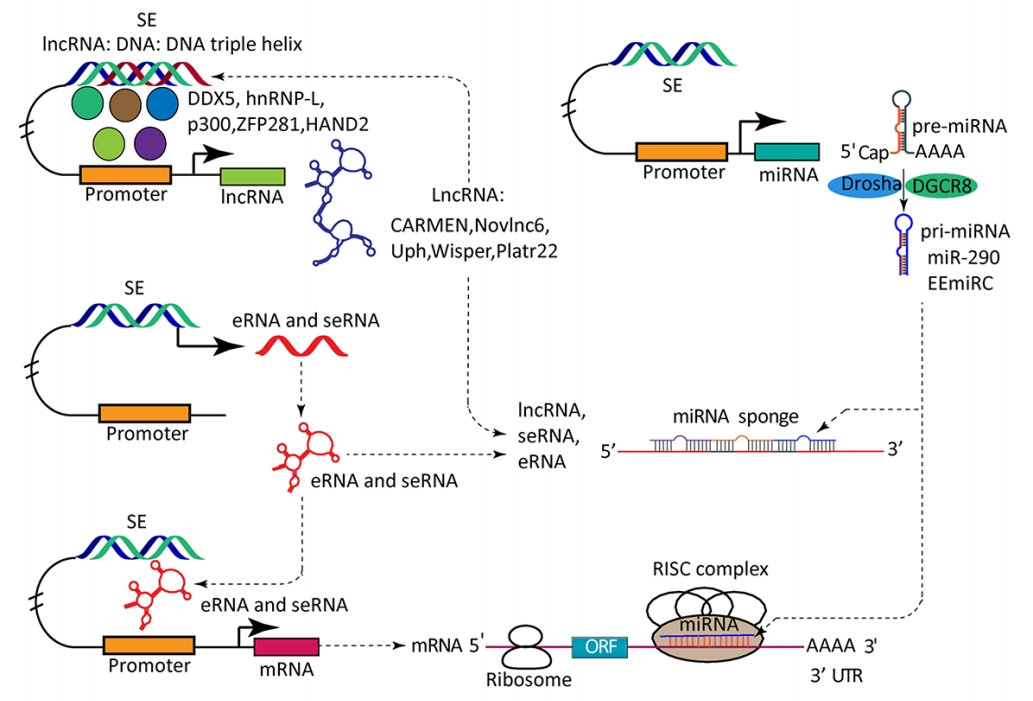 SE调控ncRNA表达的机制
SE调控ncRNA表达的机制
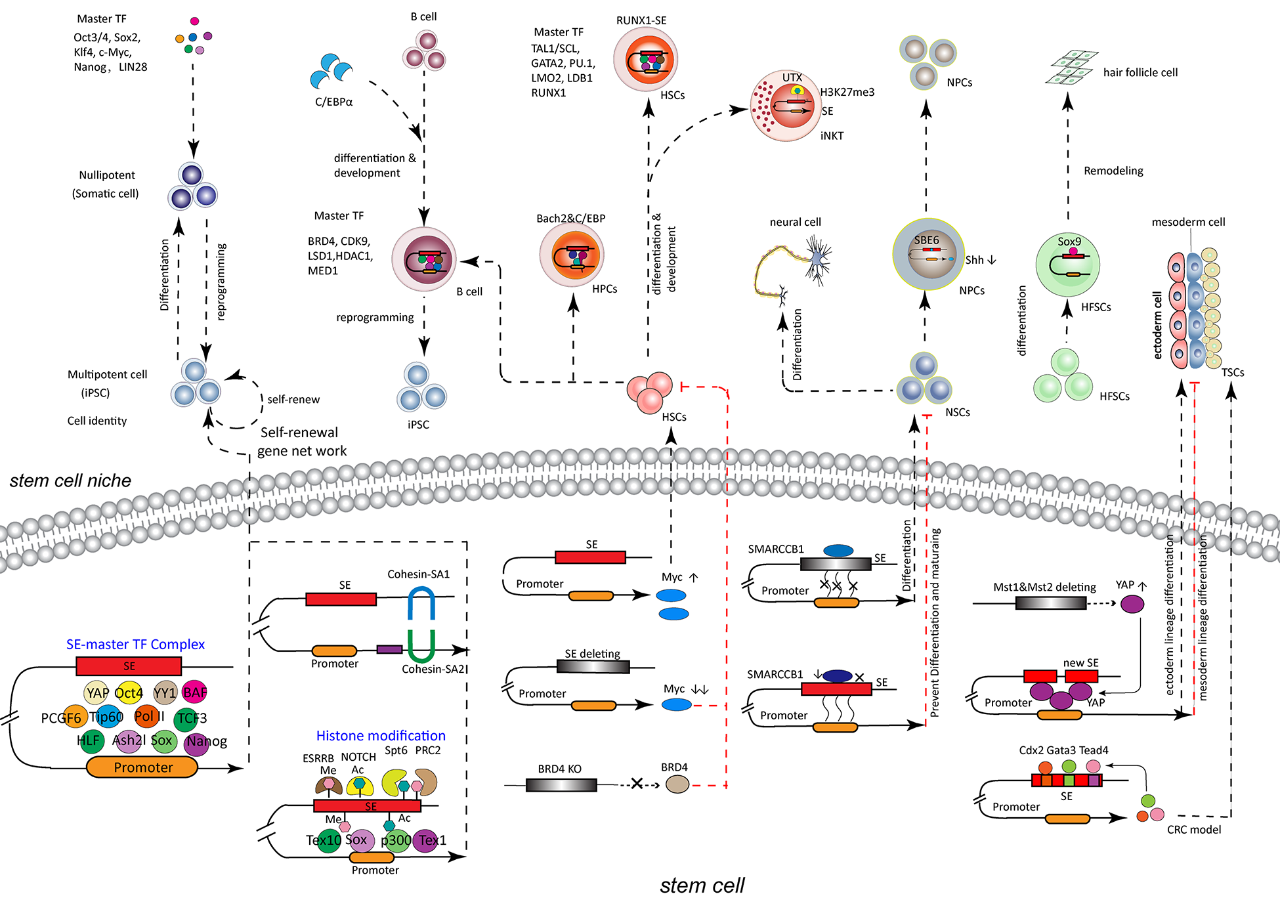
干细胞中的SE组学
癌症干细胞(CSCs)是一群具有自我更新能力和高度致瘤性的癌细胞,被认为是肿瘤发生、发展、复发和耐药的关键因素。研究发现,胚胎干细胞中的SE有时会被癌细胞“劫持”,导致癌基因的异常激活,从而促进癌症干细胞的自我更新和增殖,并赋予其耐药性。例如,在慢性粒细胞白血病中,XBP1基因的超级增强子能够维持白血病干细胞的存活和自我更新能力。
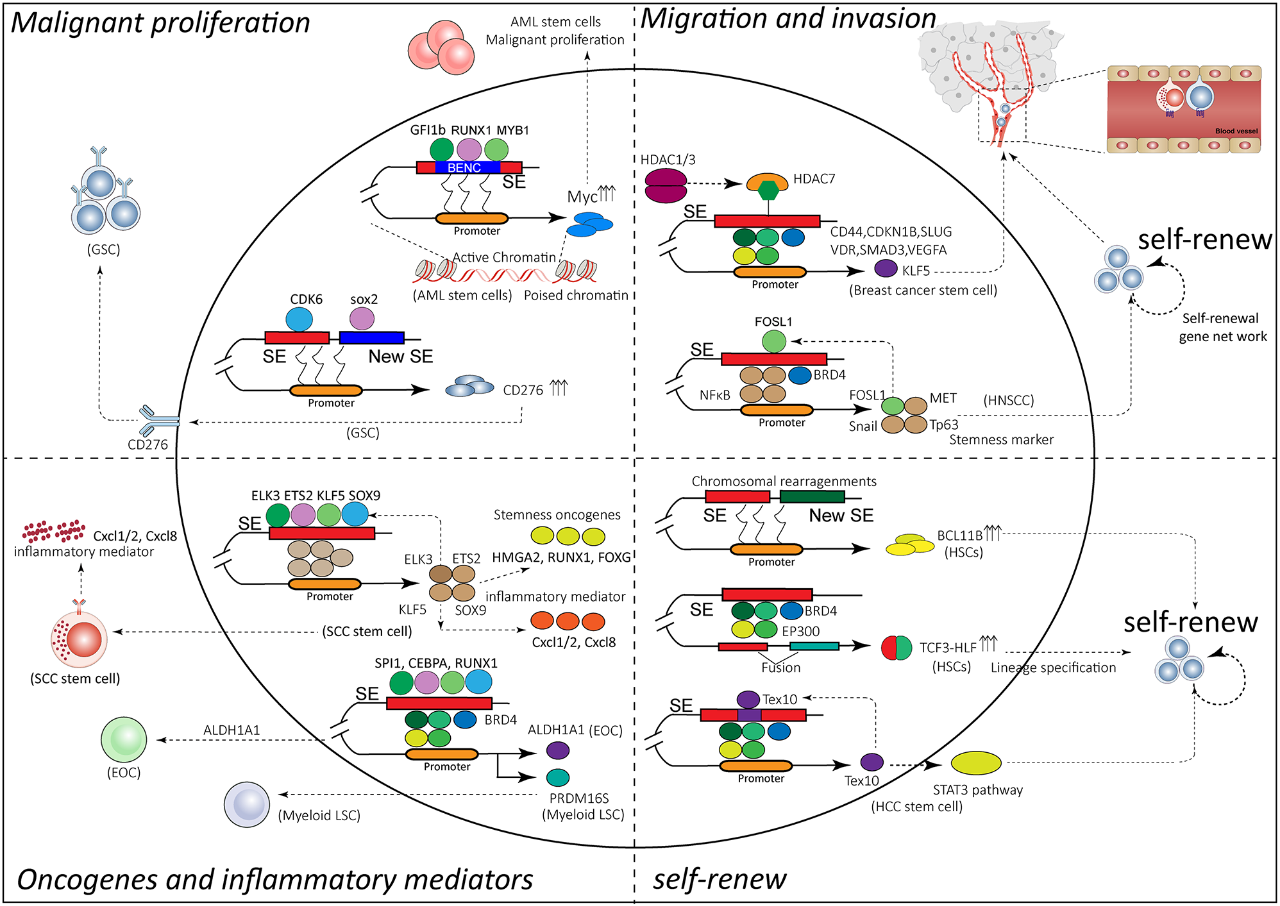
SE维持癌症干细胞的特征
鉴于SE在干细胞和癌症干细胞中的重要作用,靶向SE及其相关元件已成为干细胞治疗和癌症治疗研究的热点。目前,研究者们已经开发了多种针对SE元件的抑制剂,例如BRD4抑制剂JQ1、CDK7抑制剂THZ1、CDK8抑制剂Cortistatin A等。这些抑制剂能够有效地抑制SE的活性,从而抑制癌细胞的增殖、侵袭和转移,并提高癌细胞对化疗药物的敏感性。此外,基因编辑技术(如CRISPR/Cas9)也推动了SE功能以及开发新的干细胞治疗策略的研究。
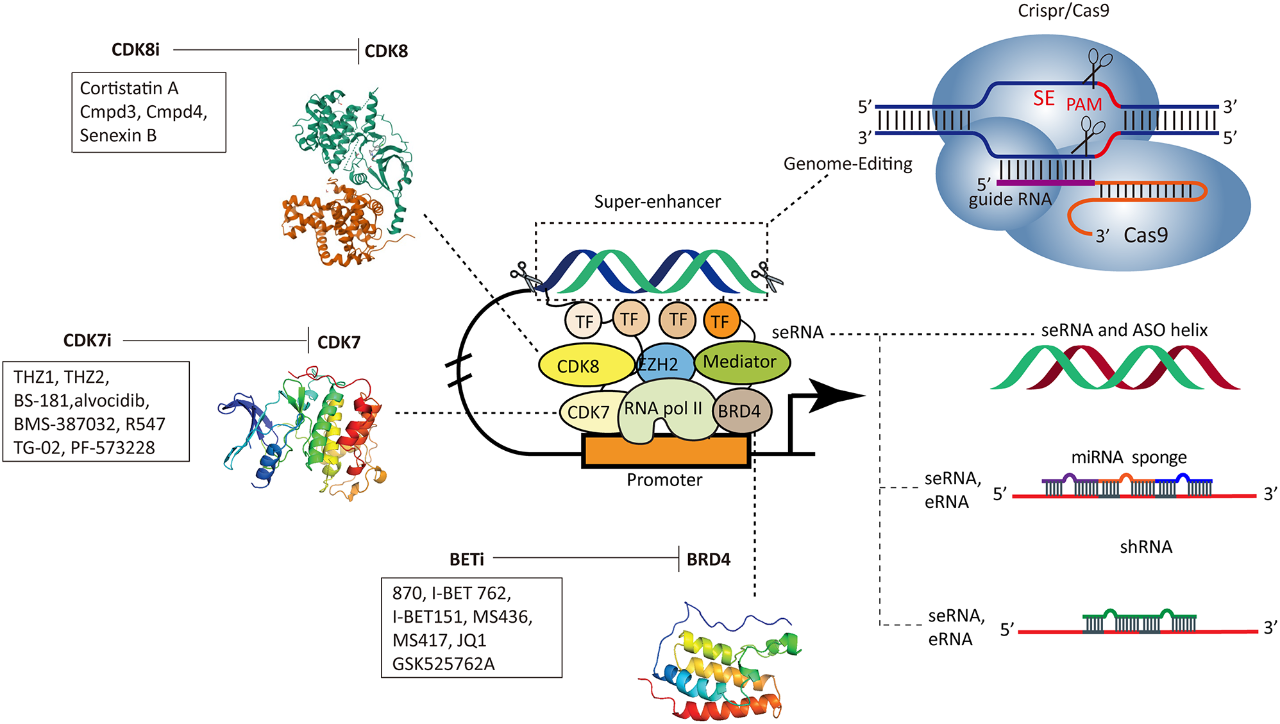
靶向SE的元件
参考文献
Ma H, Qu J, Pang Z, et al. Super-enhancer omics in stem cell. Mol Cancer. 2024;23(1):153.