Cancer Cell | 免疫检查点抑制剂介导结肠炎的分子机制
检查点抑制剂(checkpoint inhibitors, CPIs)通过阻断检查点分子介导的调节性免疫信号,重建T细胞介导的肿瘤细胞清除,进而彻底改变了癌症的治疗。不过,这些治疗策略也会导致一系列免疫相关的不良事件(immune-related adverse events, irAEs),比如胃肠道炎症,进而影响超过60%的病人。尽管在病人肠道、皮肤和关节处的irAEs与提高癌症生存率有关,但它们致残的副作用导致了日益增加的医疗负担【1】。目前对于irAEs发生的免疫病理机制尚未完全阐释清楚,只是推测与T细胞的失调激活有关【2】。
CTLA-4和PD-1分别与其配体的结合促进了T细胞耗竭,从而抑制了T细胞介导的对癌细胞的杀伤作用。CTAL-4和PD-1的抗体通过逆转上述效应恢复了T细胞对肿瘤抗原的反应能力,而CPI介导的irAEs被认为也是通过类似的机理来实现的。之前研究通过单细胞测序对CPI介导的结肠炎病发原因进行了探索,发现CD8+ T细胞、CD4+ T细胞以及调节性T细胞(Treg)浸润增加【3,4】,但这些现象发生的分子机制还未研究清楚。
近日,来自牛津大学的Alison Simmons和Hashem Koohy带领团队在Cancer Cell发表了文章Tracking in situ checkpoint inhibitor-bound target T cells in patients with checkpoint-induced colitis,研究人员通过空间转录组学以及单细胞测序技术分析了CPI结合的T细胞,并对这些T细胞介导结肠炎的深入机制进行了详细的探索和分析。

研究人员首先对来自CPI治疗的病人结肠组织和外周血单核细胞(PBMC)进行了多组学分析,包括scRNA-seq,VDJ-seq和CITE-seq,样本来自不同种类的病人,包括CPI治疗后出现结肠炎的病人,CPI治疗后没有出现结肠炎的病人,正常人组织以及非CPI治疗的炎症对照。单细胞分析鉴定出了一些CPI-结肠炎特异性的细胞类型,包括CPI特异性活化的成纤维细胞亚群,另外,上皮细胞、胶质细胞、内皮细胞和巨噬细胞等也发生了表型变化。
之后,研究人员通过空间转录组学进行了详细的探究,结果显示短暂扩增细胞(transit amplifying cell)位于肠隐窝深处,分泌细胞较为分散,二分化程度较高的肠上皮细胞则向隐窝顶部集中。同时还观察到一些免疫细胞浸润,包括CPI-结肠炎特有的T细胞、中性粒细胞和巨噬细胞等,而在溃疡性结肠炎(UC)中,浸润的免疫细胞主要来自血浆。
CITE-seq分析发现在CPI结肠炎样本中,PD-1抗体的结合率下降,PDCD1的mRNA水平和蛋白水平的对应关系减弱,进一步的检测发现,这是由于nivolumab等药物持续与PD-1结合引起的。临床数据也支持了这一结果,临床1期数据表明,nivolumab能够与T细胞持续结合超过200天,本篇研究中所选用的临床样本距离最后一次PD-1抗体用药时间在113天之内。
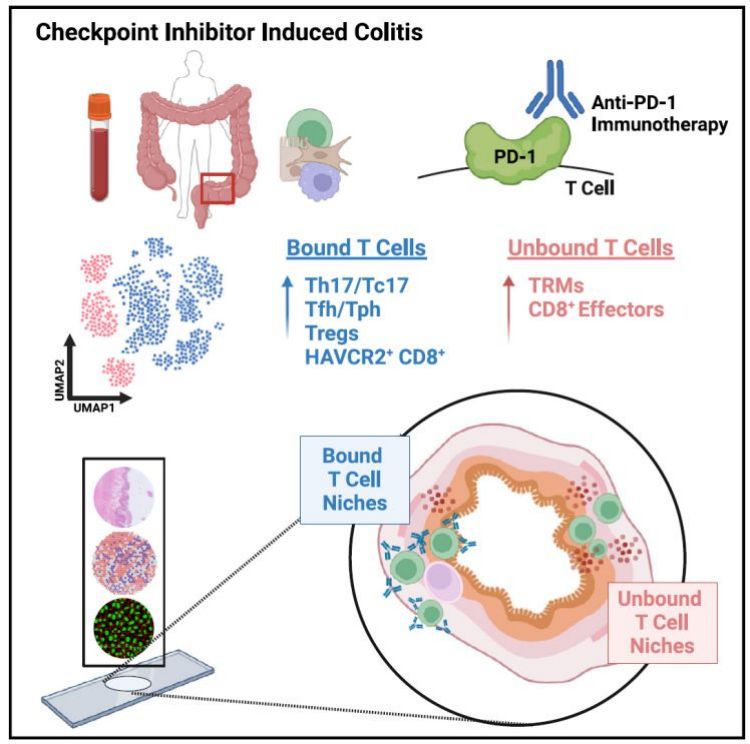
研究人员通过分析PD-1预期表达水平与真实CIPE检测水平之间的差异之处,确认了CPI-结肠炎中与CPI结合T细胞,其中与CPI结合的T细胞主要是Tfh, Th17, Tc17,循环以及CD103-/+和HAVCR2+细胞,还有少部分Treg细胞。效应细胞结合CPI的置信度较低,而静息细胞、IELs以及TRM细胞则不与CPI结合。
之后,研究人员对引发CPI结肠炎的T细胞亚型进行了鉴定,发现表达“耗竭”标记基因的CD103+HAVCR2+ T细胞亚群在CPI结合的细胞中有较高富集,这群细胞促进了CPI介导的结肠炎进展。除此之外,另外一群细胞毒性T细胞亚群(CD103-HAVCR2+)数量也增加,这个细胞亚群也表达类似“耗竭”标记基因表达谱,这群细胞可能来源于外周循环系统,尽管细胞毒性T细胞是CPI结肠炎中促炎细胞因子的主要来源,但这些细胞亚群可能是CPI结合的次要事件。另外,研究人员还发现,除了表达HAVCR2+的细胞亚群外,其他CD8+ T细胞并不与CPI结合,相反,在CPI-结肠炎组织中CD4+ T细胞更多与CPI结合。
研究人员进一步检测了CPI结合的T细胞在组织里的分布情况,发现这些T细胞通常聚集在特定的固有层区域内,通常靠近其他未结合CPI的T细胞,但不在上皮细胞之间。一些CPI结合的T细胞定位在淋巴滤泡内,位于结构的外缘附近,不过在组织的其它位置,有的滤泡内完全没有CPI结合的T细胞存在,说明存在CPI结合T细胞的滤泡可能是CPI处理后才形成的。研究人员还发现在最后一次CPI处理不到50天的病人样本中,相比CPI处理的对照组,发展为结肠炎的组织中CPI结合的T细胞数目是增加的,但在距离最后一次CPI处理超过50天的病人样本中,CPI结合的T细胞数目下降了,这表明CPI结合的T细胞也存在于未发展为结肠炎的组织中,CPI结合T细胞不是结肠炎发生的必要条件。
研究人员还对CPI结肠炎组织中CD8+ T细胞的促炎作用机制进行了探索,个体隐窝和其附近细胞通过增强Treg极化和招募抑制了CD8+ T细胞的炎症反应,然而,CPI与Tregs的结合导致了这种抑制效应的不足。
总之,本研究通过单细胞组学和空间转录组学详细分析了CPI介导的结肠炎发病过程中,结肠组织的T细胞调控炎症的分子机制,为理解和靶向治疗CPI介导的结肠炎副作用提供了深入的理论基础。
原文链接:https://doi.org/10.1016/j.ccell.2024.04.010
参考文献
1. Williams, K.C., Gault, A., Anderson, A.E., Stewart, C.J., Lamb, C.A., Speight, R.A., Rajan, N., Plummer, R., and Pratt, A.G. (2023). Immunerelatedadverse events in checkpoint blockade: Observations from human tissue and therapeutic considerations. Front. Immunol. 14, 1122430.
2. Morad, G., Helmink, B.A., Sharma, P., and Wargo, J.A. (2021). Hallmarks of response, resistance, and toxicity to immune checkpoint blockade. Cell 184, 5309–5337.
3. Luoma, A.M., Suo, S., Williams, H.L., Sharova, T., Sullivan, K., Manos, M., Bowling, P., Hodi, F.S., Rahma, O., Sullivan, R.J., et al. (2020). Molecular Pathways of Colon Inflammation Induced by Cancer Immunotherapy. Cell 182, 655–671.e22.
4. Sasson, S.C., Slevin, S.M., Cheung, V.T.F., Nassiri, I., Olsson-Brown, A., Fryer, E., Ferreira, R.C., Trzupek, D., Gupta, T., Al-Hillawi, L., et al. (2021). Interferon-Gamma–Producing CD8+ Tissue Resident Memory T Cells Are a Targetable Hallmark of Immune Checkpoint Inhibitor–Colitis. Gastroenterology 161, 1229–1244.e9.



