Mol Cancer │ 基因组结构异常驱动的SE在特定的肺腺癌中引发ERBB2过表达的机制

文章索引
【题目】Mechanism of ERBB2 gene overexpression by the formation of super-enhancer with genomic structural abnormalities in lung adenocarcinoma without clinically actionable genetic alterations
【期刊】Molecular Cancer
【见刊时间】2024年6月11日
【IF】27.7
【单位/通讯作者】日本国立癌症中心研究所癌症转化研究组Syuzo Kaneko、Ryuji Hamamoto团队
【关键词】驱动突变;肺腺癌;超级增强子;结构变异;靶向治疗
2024年6月11日,日本国立癌症中心研究所癌症转化研究组Syuzo Kaneko、Ryuji Hamamoto团队在《Molecular Cancer》上发表题为“Mechanism of ERBB2 gene overexpression by the formation of super-enhancer with genomic structural abnormalities in lung adenocarcinoma without clinically actionable genetic alterations”的研究论文。这项研究通过WGS和ChIP-seq对174例缺乏临床可操作性的基因突变的肺腺癌(lung adenocarcinoma,LUAD)患者样本进行全面研究,发现ERBB2基因区域形成的超级增强子(SE)与基因异常表达相关,并通过Hi-C和long-reads seq进一步证实结构变异(SV)将ERBB2基因区域带至HNF1β基因座附近,从而导致ERBB2表达异常升高。这项研究发现SV异常不仅与驱动基因突变无关,且与术后复发风险升高相关,为肺腺癌精准医疗提供新的视角。
01. 驱动基因突变的鉴定由利用结构变异形成的SE驱动基因
该研究为了克服LUAD患者中应用靶向治疗的挑战,拓展精准医疗范围,从来自WES和RNA-seq数据集的938例患者中选择了LUAD病例进行分类与分析,结果发现476例患者中存在驱动基因突变(占总队列的50.7%)。另外,从非CAGA(临床可操作性基因突变)的420例中选择了174例进行了WGS和H3K27ac ChIP-seq分析,结果显示非CAGA患者突变频率更高。
为阐明正常组织与肿瘤组织之间的不用特征,对7个非CAGA样本进行H3K27Ac ChIP-seq,并进行对照比较。PCA分析结果表明非CAGA患者的肿瘤样本表现出多样性特征。
接着通过WGS和H3K27Ac ChIP-seq分析,结果发现SE和SV在非CAGA患者中的重叠区域频率更高。此外,通过Manta分析和ROSE分析,结果发现整个数据集中位点数量虽然庞大,但只有约1%的位点显示出重叠区域,表明SV在特定区域中作为SE形成的直接触发因素。
这些发现揭示了SE在非CAGA LUAD患者中的潜在作用,助力非典型驱动基因的鉴定。
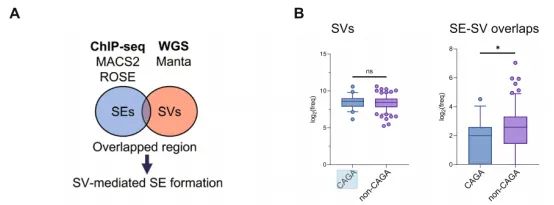
图1. A)SEs与结构变异两组重叠的基因组位点;B)CAGA和非CAGA LUAD患者中每个样本结构变异事件的log2比较(左),SE-SV重叠的比较(右)
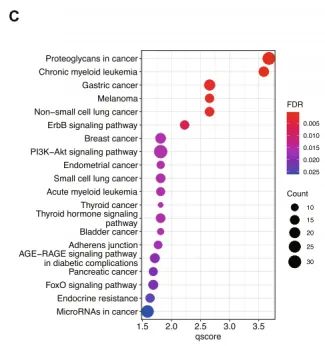
图2. 在非CAGA LUAD样本中标记为SE区域并发SV的基因簇的KEGG富集分析气泡图
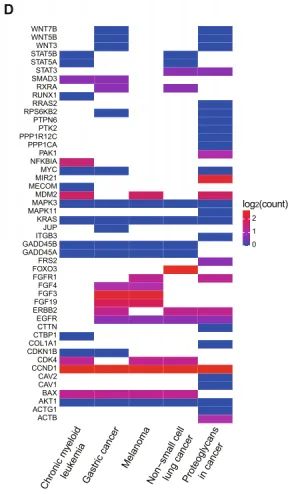
图3. 从非CAGA LUAD样本中获得的前5个富集通路的基因簇,在SE和SV重叠区域注释的单个基因计数热图
02. 基因表达对非CAGA LUAD样本中伴随SV的SE形成的影响
该研究通过对938例LUAD的RNA-seq数据进行聚类分析,结果发现非CAGA LUAD中存在类似角膜缘和角膜上皮干细胞的显著特征,而EGFR突变阳性组则在Ⅱ型肺泡细胞和上皮祖细胞中富集。进一步分析揭示了SE和SV在非CAGA LUAD中的重要作用,特别是ERBB2、EGFR、CDK4和MDM2等基因在这些区域的表达显著升高。作者发现H3K27Ac峰值与基因表达显著相关,并确定趋化因子活性通路在具有SE和SV的病例中显著参与。这些结果表明SE和SV的重叠会导致基因表达的异常升高。
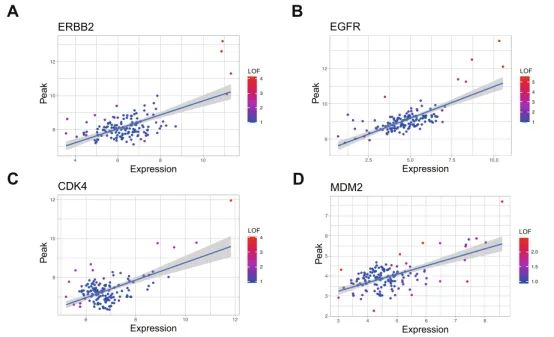
图4. A-B)ERBB2、EGFR、CDK4和MDM2基因表达峰值散点图
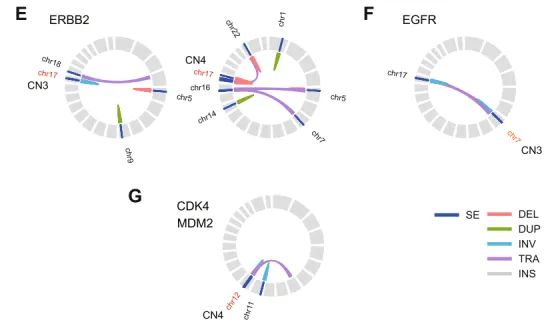
图5. E-G)单个非CAGA LUAD样本的circos图
03. 由基因表达异常升高引起的驱动突变候选对象
通过SE-基因的关联分析发现了一组异常高表达的基因,这些基因是由SE和SV驱动的驱动突变候选基因,其中FRS2(成纤维细胞生长因子受体底物 2)和CAV2(窖蛋白2)可能成为候选基因。
FRS2在激活MAPK和PI3K信号通路中发挥关键作用,被确定为致癌基因;而CAV2参与癌症进展,高表达与胰腺癌进展和不良预后相关,影响着肿瘤发展和转移过程。
这些发现提示FRS2和CAV2在非CAGA LUAD的分子动态中起重要作用,深入了解它们的分子机制可能为潜在的治疗策略提供帮助。
04. SE和SV的染色体结构与ERBB2基因位点重叠
研究发现在40.8%的非CAGA LUAD患者中,SEs形成与SVs相关,导致基因表达显著升高。其中,1.15%的患者在ERBB2基因周围形成SEs。
进一步分析发现ERBB2过表达并非通过Y1248磷酸化来激活,而可能涉及其它信号通路。
关键的是,使用泛HER激酶不可逆抑制剂--波奇替尼(Poziotinib)和抗体偶联药物--“德曲妥珠单抗(T-DXd)”对这些ERBB2过表达的LUAD模型表现出良好的抑瘤效果。
为了深入研究染色体结构变化和相互作用,该研究进一步使用Hi-C技术进行分析,结果发现ERBB2与HNF1β基因位点发生了重排,从参考基因组中的相距约1.9 Mb缩短至~125 Kb。
这些结果不仅阐明了非CAGA LUAD的复杂基因组景观,也强调了ERBB2靶向治疗在具有特定SE形成的患者群体中的应用潜力。
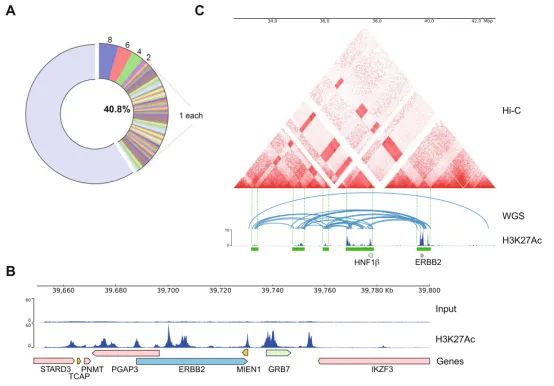
图6. A)非CAGA LUAD患者与SV相关SE形成的比例的饼图;B)LUAD中PDX模型的H3K27Ac ChIP-seq的基因组视图;C)基于Hi-C、WGS和H3K27Ac ChIP-seq对ERBB2异常表达样本分析的综合可视化
05. 培养细胞中ERBB2和HNF1β位点之间的靶向染色体重排
该研究通过CRISPR-Cas9系统诱导培养细胞中基因组结构异常,WGS和Hi-C分析结果发现ERBB2区域存在复杂的结构异常,包括与HNF1β基因座的常见染色体倒位。
通过设计gRNAs并在细胞中诱导染色体倒位,作者发现只有在同时引发ERBB2和HNF1β基因组区域的双链断裂时,约0.20-0.69%的细胞显示出HER2表达增加。这进一步证实了观察到的基因组结构异常直接影响了HER2基因的表达水平。
这些发现揭示了染色体倒位对HER2表达的影响,为进一步探索基因组结构异常与基因表达之间的关系提供了重要线索。
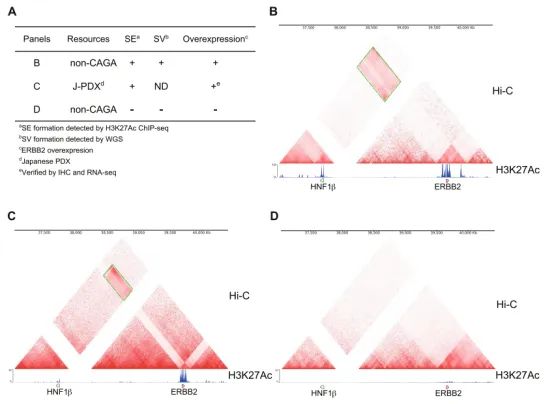
图7. A)Hi-C和ChIP-seq结合分析的案例;B-D)在ERBB2和HNF1β基因位点上发现了共同的染色体倒位(绿色框),D为阴性对照
06. 异常基因在临床预后中的意义
该研究通过对6个关键基因(CDK4、ERBB2、MDM2、FRS2、EGFR和CAV2)的SE-基因关联分析,结果发现一组显著异常高表达的潜在驱动基因。作者进一步分析了其与相关临床结果的相关性。结果表明高表达基因,特别是FGF3、FGF4和FGF19的存在均与显著降低的无复发生存期相关。这些结果强调了在没有驱动基因突变的情况下,来自SE和SV景观分析获得的基因的稳健性,这些基因具有作为预后预测因子的临床意义。
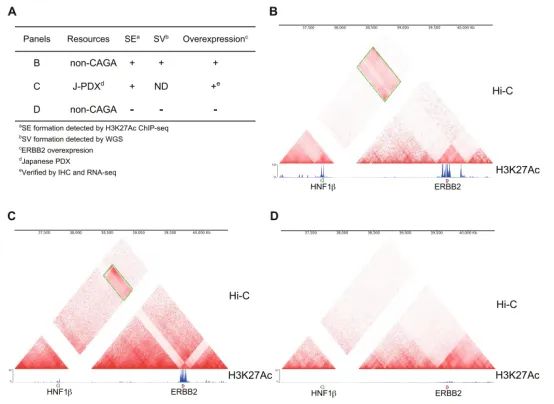 图8. A)Hi-C和ChIP-seq结合分析的案例;B-D)在ERBB2和HNF1β基因位点上发现了共同的染色体倒位(绿色框),D为阴性对照
图8. A)Hi-C和ChIP-seq结合分析的案例;B-D)在ERBB2和HNF1β基因位点上发现了共同的染色体倒位(绿色框),D为阴性对照
总结
这篇文章研究了非CAGA LUAD中SE和SV之间的复杂相互作用,揭示了它们在基因表达调控中的重要作用。通过整合WGS、H3K27ac ChIP-seq、Hi-C等技术,分析结果发现许多基因由于SE与SV的重叠而表现出异常表达。这些异常表达在某些非CAGA LUAD病例中显著增加了术后复发的风险。总之,这篇文章识别到了大量的潜在的驱动基因,从而能更准确地选择临床试验患者,这有望提高LUAD的个性化治疗方法的有效性并改善患者预后。