Science | DNA损伤诱发细胞凋亡的新通路!由核糖体停滞介导,不依赖p53
2024年5月17日,荷兰癌症研究所生物化学部Thijn R Brummelkamp团队和肿瘤基因组学部Reuven Agami团队等研究人员在Science上发表题目为“DNA damage induces p53-independent apoptosis through ribosome stalling”的研究论文。该研究揭示一种与基因Schlafen 11(SLFN11)和核糖体停滞相关的癌细胞凋亡新机制。研究发现在DNA损伤治疗中,SLFN11会关闭细胞的蛋白质工厂“核糖体”,使缺乏肿瘤蛋白p53(TP53)的癌细胞仍可发生细胞凋亡。强调了核糖体停滞是DNA损伤影响细胞命运的信号事件。
文章索引
【题目】DNA damage induces p53-independent apoptosis through ribosome stalling
【期刊】Science
【发表时间】2024年5月17日
【IF】56.9(1区)
【单位/通讯作者】荷兰癌症研究所生物化学部Thijn R Brummelkamp团队和肿瘤基因组学部Reuven Agami团队
研究结果
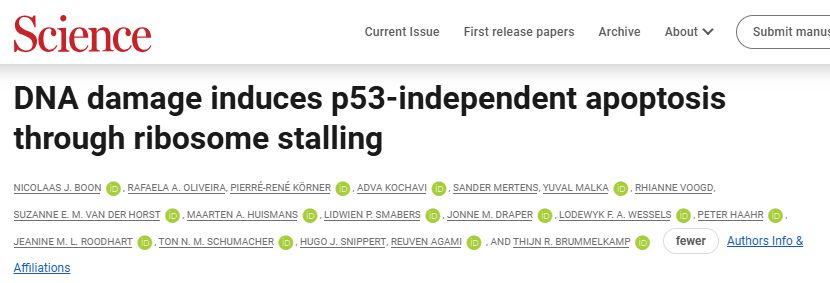
1. DNA损伤抑制翻译
该研究确定了人单倍体HAP1细胞在暴露于依托泊苷、顺铂或羟基脲后发生DNA损伤和凋亡。
通过CRISPR/Cas9技术灭活HAP1和A549细胞中TP53,这些细胞在依托泊苷作用下依然发生凋亡,证实了这种凋亡是p53非依赖性的。
进一步分析发现DNA损伤导致HAP1细胞的蛋白质合成整体减少。且这种翻译抑制与caspase-3的活化相关。DNA损伤诱导的caspase-3活化仅在低翻译的细胞群中检测到,且翻译抑制不依赖于caspase活化。
综上,DNA损伤在翻译抑制的细胞中选择性激活凋亡caspase,且caspase活化本身不需要翻译抑制。
2. DNA损伤导致核糖体停滞
为进一步研究DNA损伤后的翻译抑制,该研究通过核糖体印迹测序Ribo-seq(表观生物可提供该技术服务)分析了mRNA的核糖体保护片段(RPFs),使用差异核糖体密码子读取(diricore)方法检测核糖体在密码子类型,结果发现DNA损伤引起翻译起始抑制和核糖体在罕见亮氨酸编码UUA密码子处的停滞。qPCR结果表明这种停滞与UUA对应的tRNA丰度减少有关,表明DNA损伤不仅导致翻译的整体减少,且导致特定密码子UUA处的翻译停滞。
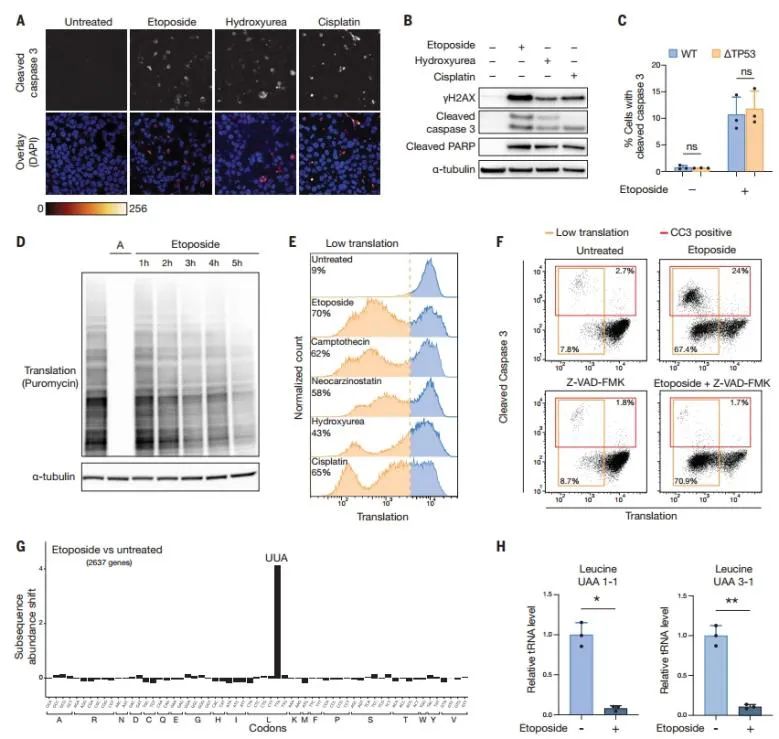
图1. DNA损伤导致罕见的亮氨酸密码子UUA的翻译和核糖体停滞的整体减少
3. 翻译抑制和核糖体停滞需要SLFN11
该研究通过基因筛选实验,在HAP1细胞暴露于依托泊苷后,将嘌呤霉素掺入信号相对“高”和“低”的细胞群进行分离,并通过深度测序绘制了基因陷阱插入图谱,以识别在“高翻译”与“低翻译”细胞群中富含破坏性突变的基因。
在依托泊苷处理的筛选中,SLFN11和蛋白GCN2是最富集的基因。SLF11编码一种tRNA酶,与DNA损伤敏感性有关,常通过启动子甲基化失活。
该研究发现,SLFN11缺陷导致翻译抑制变弱,且与DNA损伤相关的核糖体停滞和tRNAUUA下调消失。
综上,SLFN11在DNA损伤响应中通过诱导核糖体在UUA密码子处停滞,触发了需要GCN2的全局翻译抑制。
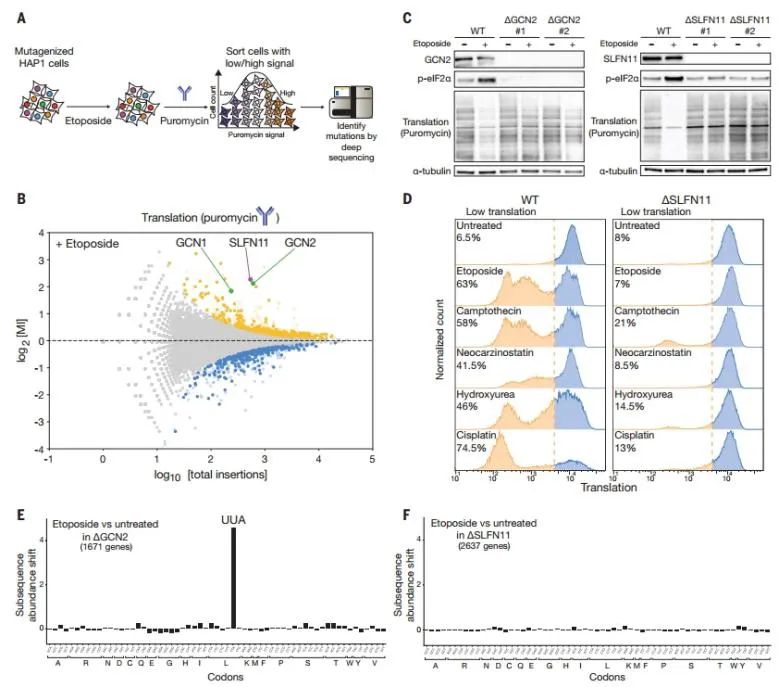
图2. SLFN11对核糖体UUA延迟至关重要;GCN2介导翻译的全局抑制
4. SLFN11介导p53非依赖性细胞凋亡
该研究通过基因筛选方法确定依托泊苷诱导细胞凋亡所需的基因,结果发现SLFN11为caspase-3激活的关键基因,而GCN2缺失不影响凋亡。
SLFN11通过诱导核糖体在UUA密码子处停滞和触发全局翻译抑制,在响应DNA损伤中起关键作用,表明其在DNA损伤诱导的凋亡中发挥不可或缺的作用。
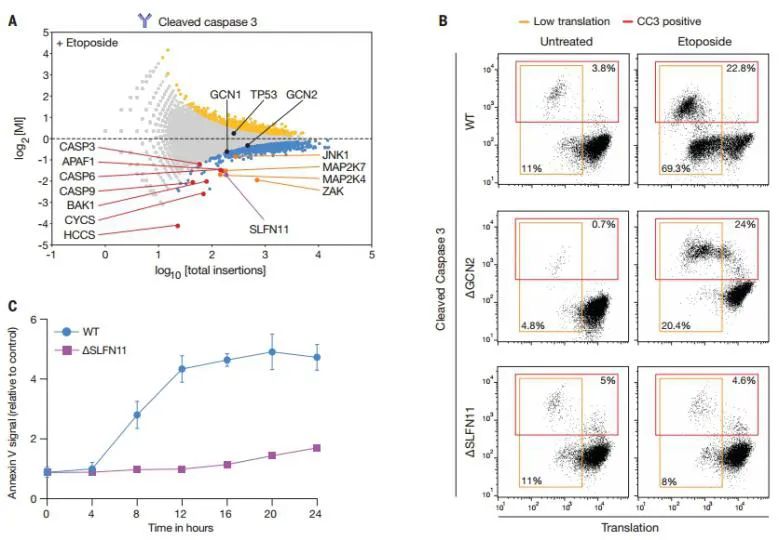
图3. DNA损伤通过SLFN11激活p53非依赖性细胞凋亡
5. DNA损伤诱导的核糖体毒性应激信号激活细胞凋亡
通过免疫印迹分析检测了ERK1/2、p38和JNK的激活。JNK激活完全依赖SLFN11,而ERK和p38不受影响。
该研究设计了两个遗传JNK激活筛选,结果发现只有DNA损伤诱导的JNK激活需要SLFN11。
SLFN11在响应DNA损伤时,与ZAKα共同作用,调控eIF2α磷酸化和MAPK信号传导级联反应。
综上,这些结果均表明SLFN11在DNA损伤中触发核糖体停滞的重要作用。
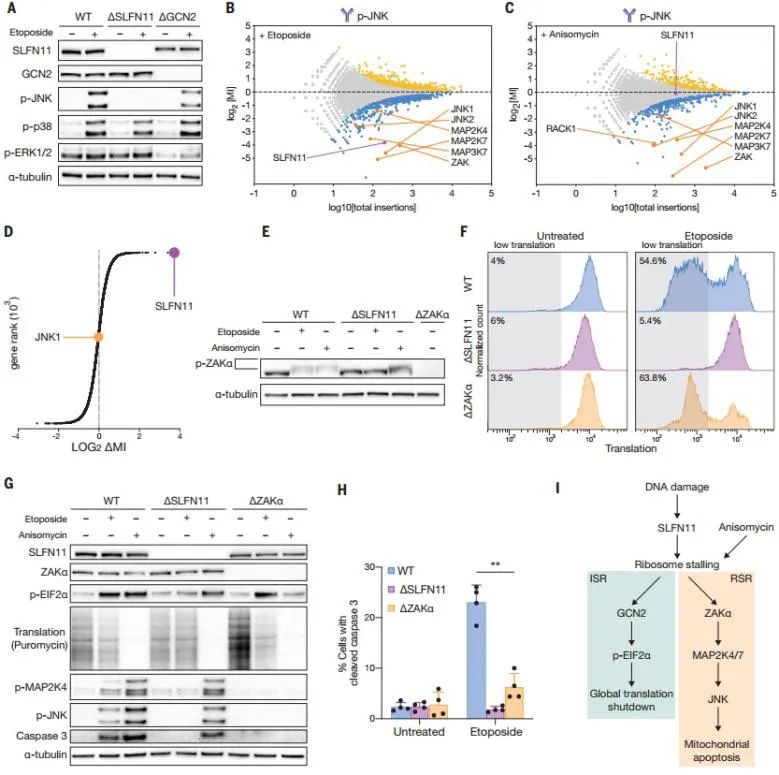
图4. SLFN11诱导的核毒性应激信号激活ZAKa并导MAPK依赖性细胞凋亡
讨论
本研究论文探讨了在DNA损伤下,细胞如何在缺乏p53的情况下通过核糖体UUA停滞诱导细胞凋亡。研究发现,这一反应不仅在不同来源的癌细胞系中观察到,也出现在从人类结直肠癌获得的不同患者衍生的类器官中。此外,健康的原代人T细胞中也检测到了DNA损伤引起的核糖体在UUA密码子处停滞,这可能导致基因毒性癌症疗法的不良副作用。SLFN11在病毒免疫和细胞基因毒性应激信号中发挥双重作用,类似于cGAS-STING,通过感知异常DNA诱导炎症状态。这一机制有助于解释SLFN11作为化疗反应性最强的生物标志物的重要性。
参考文献:
Boon NJ, Oliveira RA, Körner PR, et al. DNA damage induces p53-independent apoptosis through ribosome stalling. Science. 2024;384(6697):785-792.



