专家解读Cell丨mRNA乙酰化修饰的重要发现与生物学意义
解读丨李笑雨、伊成器(北京大学生命科学学院)
责编丨迦 溆
当前研究已经在RNA上发现了超过100种不同类型的转录后修饰【1】,这些修饰大部分分布在rRNA、tRNA等高丰度的ncRNA上,并且对这些RNA的生物学功能起着重要的作用。然而,对于mRNA上的化学修饰的研究,包括修饰类型以及功能研究仍然处于起步阶段。目前为止,在真核生物mRNA的内部已有m6A,m6Am,I,m5C,hm5C,Ψ,m1A,Nm被报道,近年来越来越多的研究报道发现mRNA上的转录后修饰呈现出动态变化的特征并且参与多种RNA调控过程【2】。N4-acetylcytidine(ac4C)最开始被发现存在于细菌tRNAmet的反密码子的第一位【3】,并且对于蛋白合成中的编码准确性是必须的【4】。在真核生物RNA中,ac4C被发现存在于serine及leucine tRNA和18S rRNA上,并且由NAT10及其同源蛋白所催化。2016年研究人员利用质谱发现ac4C也存在于人的mRNA上【5】,然而对于ac4C的分布规律及其对于mRNA的调控作用仍然有待研究。
近日,美国国家癌症研究所的Shalini Oberdoerffer课题组在Cell期刊上发表了一篇题为Acetylation of Cytidine in mRNA Promotes Translation Efficiency的研究论文,他们发现mRNA上的ac4C修饰也由NAT10催化,并且获得了全转录组水平的ac4C修饰谱图,ac4C主要富集在CDS区域并在5’ UTR也有一定富集。作者进一步利用多种研究手段发现mRNA上的ac4C有助于促进其稳定性并且增强其翻译效率。

作者利用dot blot、LC-MS/MS及Immuno Northern blot多种研究手段证实ac4C修饰确实存在于mRNA上,并且发现在NAT10敲除细胞系中mRNA上的ac4C修饰水平显著下降,说明NAT10不仅可以催化tRNAser、tRNAleu 和18S rRNA上的ac4C修饰也可以作用于mRNA。作者进一步利用特异识别ac4C的抗体富集含有ac4C的mRNA片段并结合高通量测序开发了名为acRIP-seq的测序方法,实现了全转录组水平的ac4C修饰谱图的鉴定。对鉴定到的ac4C peak进行分析,发现它们主要富集在5’UTR与CDS区域,尤其是CDS区域。
通过RNA差异表达分析,作者发现含有ac4C修饰的转录本在NAT10缺失之后表达量发生了明显下降,并且在表达量下降的转录本中,ac4C修饰主要发生在CDS区域。进一步作者排除了转录的变化造成的转录本表达量下降,并且利用BRIC-seq进行了转录本稳定性分析,发现NAT10缺失之后,与不含有ac4C修饰的转录本相比,CDS区域含有ac4C修饰的转录本的half-life明显下降,说明ac4C修饰有助于促进mRNA的稳定性。
利用Ribosome profiling等手段,作者发现mRNA上的ac4C修饰可以促进mRNA翻译。通过分析密码子偏好性,含有ac4C的转录本富集了第三位(wobble site)为C的密码子。进一步利用体内与体外翻译系统,作者都发现wobble site上的ac4C修饰显著促进了翻译,说明mRNA上的ac4C修饰可以影响tRNA选择进而调控mRNA的翻译。
值得一提的是由于ac4C也存在于tRNAser、tRNAleu及18S rRNA上并且也由NAT10催化,作者利用多种研究手段证实了在NAT10缺失细胞系中观察到的含有ac4C修饰的基因表达量变化及翻译速率的变化是由mRNA上ac4C修饰所特异调控的,而不是受到tRNA及18S rRNA上的ac4C修饰变化的影响。
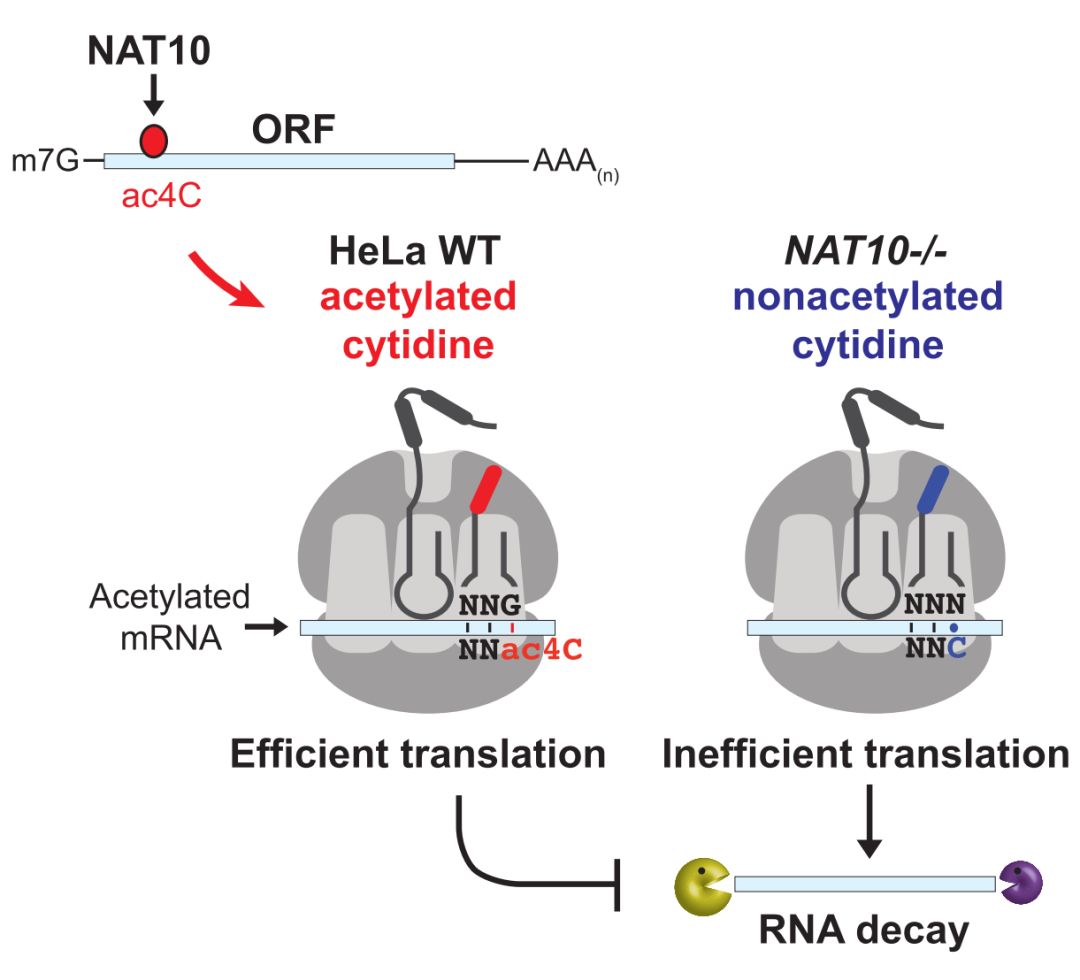
综上所述,这篇文章在mRNA上鉴定到了一种新型乙酰化修饰ac4C,与mRNA上研究较多的m6A修饰相比,ac4C具有不同的分布规律及调控功能,这一发现扩展了mRNA上的修饰种类与功能的研究。与此同时,ac4C被发现富集在5’UTR与CDS区域,这篇文章主要对于CDS上的ac4C修饰功能进行了研究,对于5’UTR上的ac4C调控的功能,以及该修饰能否被去除,相应的去除酶类,识别蛋白等,及其在发育及疾病发生过程中的作用仍有待进一步探索。
注:北京大学生命科学学院伊成器实验室长期致力于DNA/RNA修饰及去修饰的生物学通路、功能和机制研究。近年来在包括Cell Stem Cell,Nat. Chem. Biol.,Molecular Cell,Nat. Commun.,Nat. Methods,PNAS等杂志上发表多项原创性成果(2016 Nature Methods年度技术:表观转录组分析——北大伊成器受邀发表相关综述文章;伊成器、汤富酬合作发布小鼠早期胚胎中5fC精细图谱)。
参考文献
1. Boccaletto, P. et al. MODOMICS: a database of RNA modification pathways. 2017 update. Nucleic Acids Res 46, D303-D307, doi:10.1093/nar/gkx1030 (2018).
2. Roundtree, I. A., Evans, M. E., Pan, T. & He, C. Dynamic RNA Modifications in Gene Expression Regulation. Cell 169, 1187-1200, doi:10.1016/j.cell.2017.05.045 (2017).
3. Stern, L. & Schulman, L. H. The role of the minor base N4-acetylcytidine in the function of the Escherichia coli noninitiator methionine transfer RNA. J Biol Chem 253, 6132-6139 (1978).
4. Taniguchi, T. et al. Acetate-dependent tRNA acetylation required for decoding fidelity in protein synthesis. Nat Chem Biol 14, 1010-1020, doi:10.1038/s41589-018-0119-z (2018).
5. Dong, C. et al. tRNA modification profiles of the fast-proliferating cancer cells. Biochem Biophys Res Commun 476, 340-345, doi:10.1016/j.bbrc.2016.05.124 (2016).

BioArt,一心关注生命科学,只为分享更多有种、有趣、有料的信息。关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:fullbellies 或邮箱:sinobioart@bioart.com.cn
- - - 推荐阅读 - - -
最新发布| 国家重点研发计划“干细胞及转化研究”立项超1/4与表观遗传机制相关
国家重点研发计划“干细胞及转化研究”重点专项2018年度拟立项项目信息已于今天公示,拟立项项目共计30项。 根据《国务院关于改进加强中央财政科研项目和资金管理的若干意见》(国发[2014]11号)、《国务院
2018-06-04

Cell Rep: 生信分析揭示RBP与癌症的关系
RNA结合蛋白(RBP)是转录后调控过程中的一类重要调控因子,决定了成千上万RNA分子的功能和命运。研究已发现一些RBP的功能异常导致了包括癌症等多种疾病的发生,但是绝大部分RBP在癌中的功能仍不清楚。 近
2018-05-16
辛辛那提大学陈建军教授最新综述:肿瘤m6A研究成果与展望!推荐深读!
来自辛辛那提大学的陈建军教授上个月在Cell Research上发表了一篇综述,总结了m6A修饰失调与多种肿瘤发病、药物应答相关的病理机制,在此基础上,讨论针对m6A修饰失调的肿瘤治疗药物研发的可行性。
2018-05-10
