Cell Rep: 生信分析揭示RBP与癌症的关系

RNA结合蛋白 (RBP) 是转录后调控过程中的一类重要调控因子,决定了成千上万RNA分子的功能和命运。研究已发现一些RBP的功能异常导致了包括癌症等多种疾病的发生,但是绝大部分RBP在癌中的功能仍不清楚。
近日,中山大学生命科学学院杨建华教授课题组在细胞出版社旗下期刊《细胞报告》(Cell Reports) 上发表了题为“Comprehensive Genomic Characterizationof RNA-binding Proteins across Human Cancers”的最新研究论文,运用生物信息学的方法整合分析来自15种癌症的近7000个临床样本的RNA测序数据、SNP6.0 芯片数据以及DNA测序数据,系统研究了1542个RBP在癌中的基因组变异图谱和功能。论文第一作者为王泽林博士和李斌博士,以下是此研究一作王博士为我们带来的文章详细解读。
在这项研究中,作者分别对15种不同的癌症的组织及相对应的癌旁组织的RBP进行了分析,鉴定出这15种癌症各自的差异表达RBP,其中绝大部分在癌中发生了显著的下调(图1A)。通过多种癌间的比较分析,作者揭示了47.1%失调的RBP只在单种癌类型中呈现(图1B),暗示了这些RBP可能具有作为癌特异诊断标志物的潜力。此外,作者还鉴定了36个在至少10种癌类型中都发生显著失调的RNA结合蛋白,说明它们在癌中的功能可能是保守的(图1C)。
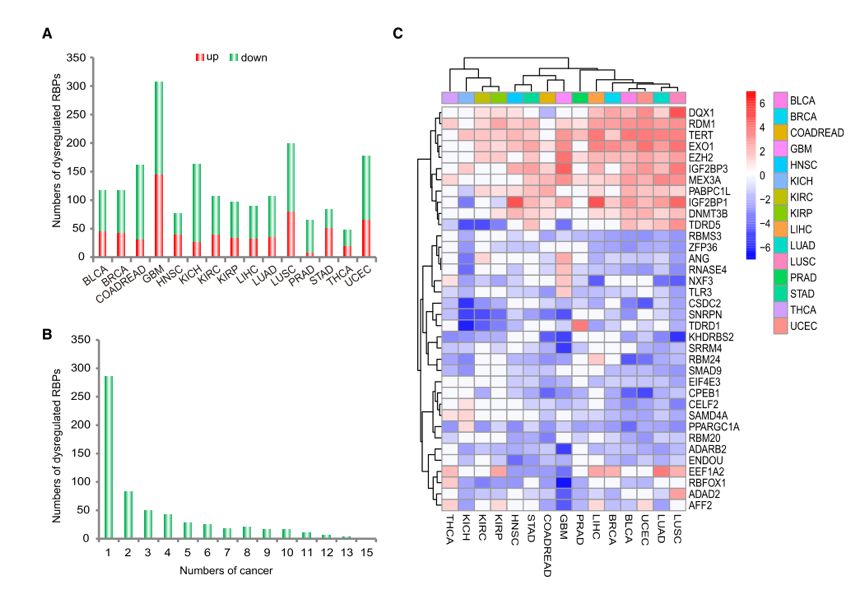
图1 RNA结合蛋白在15癌类型中的表达模式分析。(A)每种癌中显著失调的RBP数目,红色代表上调,蓝色代表下调。(B)失调的RBP在15种癌类型中的分布情况。(C)在至少10种癌类型中失调的36个RBP。基于log2转化的倍数变化值,R中的pheatmap包被用来执行无监督聚类分析。红色代表上调,蓝色代表下调。
RBP拷贝数变化分析
为了研究RBP在癌中表达异常的分子机制,作者对RBP的DNA拷贝数变化情况进行了分析。作者发现超过60%的RBP在癌中发生了频繁的拷贝数变化,且表达与拷贝数值显著正相关(图2A)。这表明了DNA拷贝数变化可能是扰乱RBP表达的一个重要机制。作者开发了一个计算机方法鉴定了76个潜在的具有癌驱动(cancer driver)能力的RBP(图2B和C)。此外,作者也发现RBP与转录因子及表观遗传调控因子具有相同的拷贝数变化模式(图2D)。

图2 RBP在癌症中的拷贝数变化图谱。(A)发生频繁拷贝数变化的RBP在染色体上的分布情况,“Combine Type”代表在不同癌类型中发生频繁拷贝数扩增或删除的RBP。(B-C) 76个发生频繁拷贝数变化的癌驱动RBP在15种癌类型中的分布。橙色代表扩增和上调,绿色代表删除和下调。(D)RBP与转录因子以及表观遗传调控因子在15种癌类型中的拷贝数变化比例比较情况。
突变RBP分析
通过对RBP的突变进行分析,作者从15种癌类型中鉴定了139个显著突变的具有癌驱动能力的RBP,绝大部分被预测作为抑癌基因(图3A)。作者将这些突变的癌驱动RBP候选与拷贝数变化的癌驱动RBP候选进行比较分析,发现两者之间仅有小部分RBP存在重叠(图3B), 表明拷贝数变化和突变这两种机制在肿瘤中是相互排斥的。作者进一步对不同癌中突变的癌驱动RBP候选进行比较分析,发现绝大部分癌驱动RBP候选都是癌特异的(图3C)。
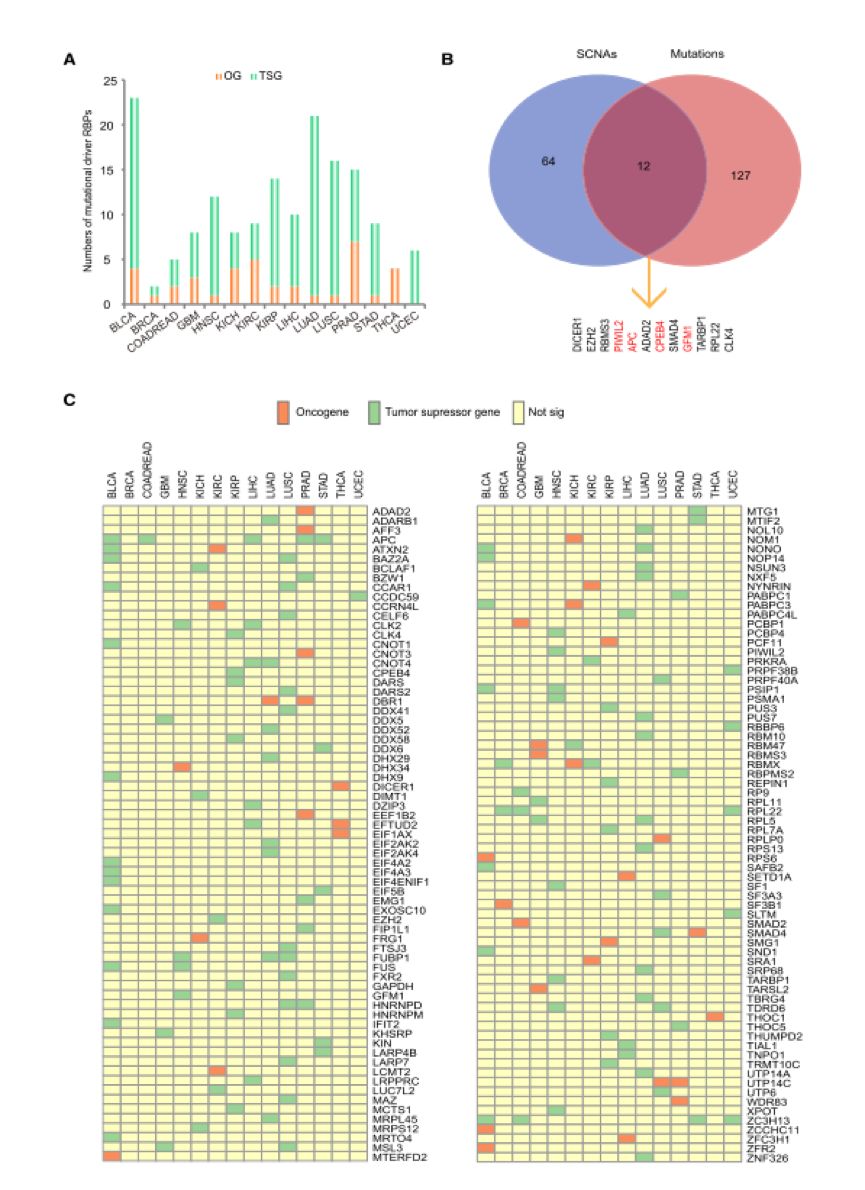
图3 鉴定显著突变的RRBP。(A)显著突变的RBP在每种癌类型中的数目统计。OG代表原癌基因,TSG代表抑癌基因。(B)韦恩图显示了发生频繁拷贝数变化和突变的驱动RBP之间的交集。标记为红色的RBP代表无论受到拷贝数变化影响还是突变影响,都导致基因功能被抑制。(C)热图显示了显著突变的驱动RRBP在15种癌类型间的分布。
细胞实验鉴定RBP功能
为了评估所鉴定的癌相关的RBP是否在癌症中具有重要的功能,作者利用功能获得性和缺失性等实验验证了BYSL、ZC3H13、ELAC1、RBMS3、 NSUN6以及ZGPAT这6个随机挑选的癌相关的RBP在结肠癌和肝癌细胞系中的癌基因功能特性。结果表明,当在HCT116和SW480细胞系中过表达ELAC1,或者敲低BYSL或ZC3H13的表达时,结肠癌细胞的数目发生明显减少(图4 A-F);当在Huh-7和SK-hep-1中过表达RBMS3、NSUN6或ZGPAT时,肝癌细胞数目都发生了明显的减少(图4 G-I)。
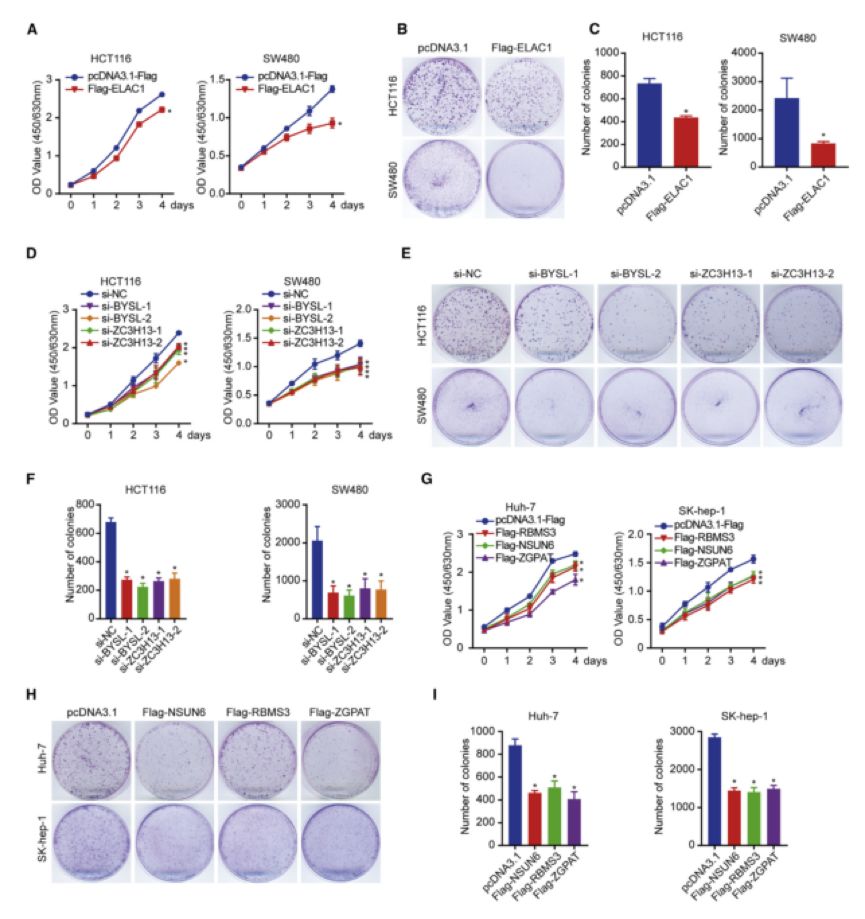
图4. 六个癌相关的RBP候选在结肠癌和肝癌细胞系中的功能验证。(A-C)CCK-8(A)和克隆形成试验(B)以及相对应的计数(C)显示了过表达ELAC1对HCT116和SW480细胞系增殖的影响。(D-F)CCK-8(D)和克隆形成试验(E)以及相对应的计数(F)显示了敲低BYSL或ZC3H13对HCT116和SW480细胞系增殖的影响。(G-I)CCK-8(G)和克隆形成试验(H)以及相对应的计数(I)显示了过表达NSUN6、RBMS3和ZGPAT对Huh-7和SK-hep-1细胞系增殖的影响。 CCK-8实验测量时间较短,而克隆形成实验在细胞培养至少10天后进行了测定。克隆形成实验的量化基于来自三次独立实验的means ± SEM。*p < 0.05 (T检验).
总结
本研究的主要发现如图5所示。本研究不仅为解析RBP的生物学功能提供了新的切入点,也为将来的癌症研究提供了新的思路。
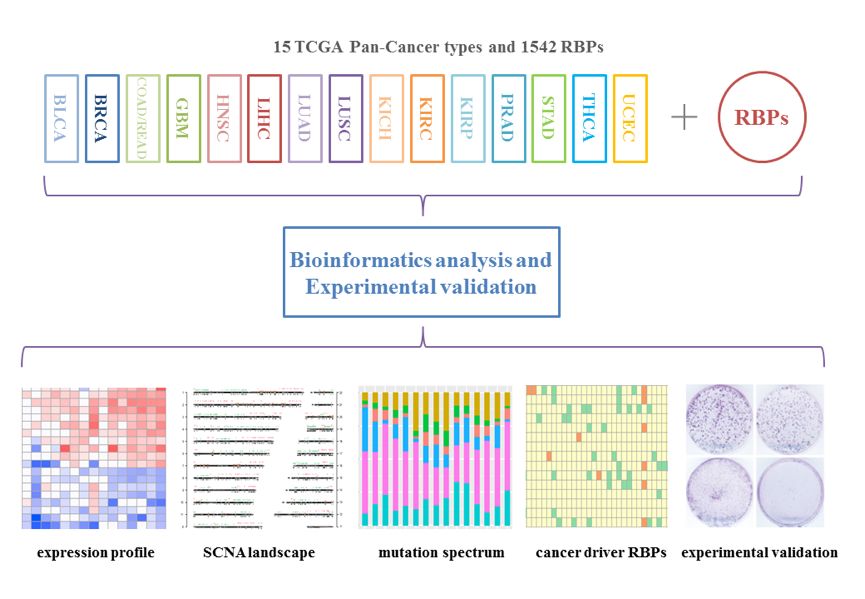
图5 本研究的主要发现。本研究通过整合分析15种癌类型的(~7000临床样本)的DNA和RNA组学数据,揭示了RBP在癌症中的基因组变异图谱,并鉴定了一批在癌中可能具有重要功能的RBP。
原文:Wang ZL, et al. Comprehensive Genomic Characterization of RNA-Binding Proteins across Human Cancers. Cell Rep. 2018 Jan 2;22(1):286-298. PMID: 29298429
作者简介
王泽林,第一作者,中山大学博士研究生,主要研究方向为生物信息学和癌症基因组学,对肿瘤相关研究具有浓厚兴趣。目前已作为第一作者或共同第一作者在Cell Reports,Oncotarget,Human Molecular Genetics 等杂志上发表多篇SCI论文。
杨建华教授,通讯作者,中山大学博士生导师,长期致力于开发新算法、平台和实验方法研究非编码RNA基因和RNA修饰及其互作蛋白的结构、功能和作用机制。以通讯作者或第一作者身份在Nature Cell Biology、Cell Research、Nucleic Acids Res.、Cell Reports等杂志发表20多篇研究论文,以合作者身份在Nature Methods、Cell Stem Cell等杂志发表10多篇研究论文。开发starBase、starScan、snoSeeker和ChIPBase等工具被Nature等杂志引用超过1200次,受邀在Springer出版社出版了3篇关于非编码RNA研究方法的论著章节。目前担任Non-coding RNA杂志的编委。
推荐阅读
● 辛辛那提大学陈建军教授最新综述:肿瘤m6A研究成果与展望!推荐深读!
● NEJM重磅综述: 表观遗传在疾病中的作用!影响因子72.40值得收藏
● NCB: 一种新的m6A阅读器!可促进mRNA翻译和稳定性
● 振奋人心的3D基因组技术:GRID-seq探索RNA-DNA相互作用
- - - 推荐阅读 - - -
辛辛那提大学陈建军教授最新综述:肿瘤m6A研究成果与展望!推荐深读!
来自辛辛那提大学的陈建军教授上个月在Cell Research上发表了一篇综述,总结了m6A修饰失调与多种肿瘤发病、药物应答相关的病理机制,在此基础上,讨论针对m6A修饰失调的肿瘤治疗药物研发的可行性。
2018-05-10

NEJM重磅综述: 表观遗传在疾病中的作用!影响因子72.40值得收藏
2018年,国际顶级医学期刊新英格兰医学杂志首次发文阐述表观遗传在疾病中的作用,你值得拥有。
2018-04-16

NCB: 一种新的m6A阅读器!可促进mRNA翻译和稳定性
m6A是在真核细胞mRNA中最普遍存在的修饰,需由阅读器(reader)识别(比如YTH结构域蛋白),调控mRNA的命运。近日,中山大学杨建华教授团队、辛辛那提大学陈建军教授以及芝加哥大学何川教授团队等合作,发现IGF2BP
2018-04-12
