辛辛那提大学陈建军教授最新综述:肿瘤m6A研究成果与展望!推荐深读!
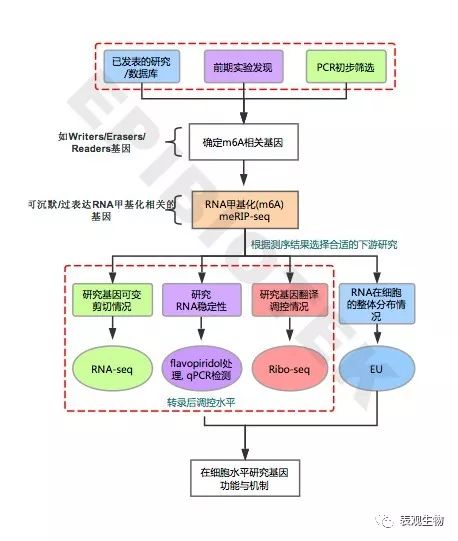
m6A作为真核细胞丰度最高的mRNA修饰,已发现在许多正常生物过程中发挥重要的作用,如组织发育、干细胞自我更新和分化、热休克或DNA损伤应答等。m6A修饰机制在正常生物过程中如此重要,与癌症的发生、发展和药物应答的关系也十分密切。来自辛辛那提大学的陈建军教授上个月在Cell Research上发表了一篇综述,总结了m6A修饰失调与多种肿瘤发病、药物应答相关的病理机制,在此基础上,讨论针对m6A修饰失调的肿瘤治疗药物研发的可行性。文中所引用的都是最新最前沿的研究成果,具有很好的实验设计参考价值。
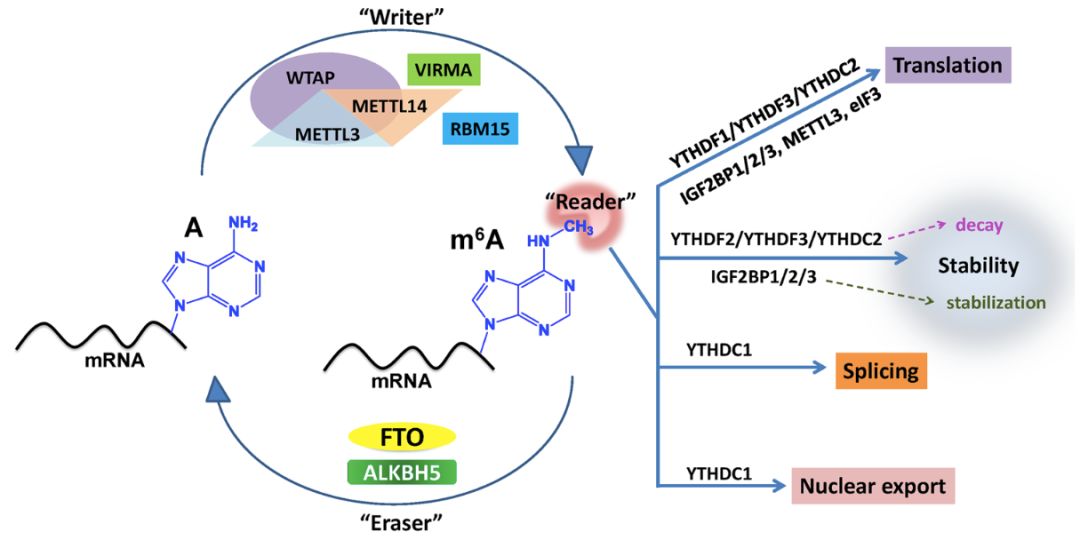
m6A甲基转移酶复合物由METTL13、METTL14和WTAP组成,可能还包括VIRMA和RBM15,充当m6A writer (书写器),去甲基化酶 (如FTO, ALKBH5)充当erasers (擦除器),还有一系列m6A结合蛋白 (YTHDF1/2/3, YTHDC1/2, IGF2BP1/2/3, METTL3和eIF3) 作为 readers (阅读器),决定m6A修饰的靶mRNA转录本的命运。
FTO与白血病和脑癌
科学家发现,FTO基因位点上的单核苷酸多态性(SNP)和肥胖、糖尿病关系密切,所以FTO在近十年变得很出名。虽然这个结果具有争议性,但是在小鼠模型中,FTO对脂肪量、脂肪生成和体重确实有着重要的调控作用,且人成纤维细胞和血细胞的SNP风险表型与FTO表达上升之间存在着联系。
案例1: Li Z, et al. Cancer Cell. 2017
为了研究FTO对肿瘤的病理作用,研究者分析了几组急性髓细胞白血病(AML)患者大样本的全基因组基因表达数据,发现FTO在AML的某些特定亚型中高表达,包括t(11q23)/MLL-重组、t(15;17)/PML-RARA、FLT3-ITD或NPM1突变。
在体内和体外的功能获得性、缺失性实验中,他们发现FTO表达的增加,使人AML细胞存活率、增殖能力提高,促进正常造血干/祖细胞(HSPC)的癌化,并抑制ATRA诱导的AML细胞分化。重要的是,研究者发现FTO,是作为一个m6A去甲基化酶(demethylase)发挥这个作用的,它能在转录后调控它的关键靶RNA表达。
研究者还进行了全转录组m6A-seq、荧光素酶报告基因和突变实验、mRNA稳定性实验和基因特异m6A-qPCR实验,结果表明FTO通过降低m6A修饰丰度、从而降低靶mRNA转录本的稳定性,负调控ASB2和RARA表达。
R-2-hydroxyglutarate (R-2HG),在异柠檬酸脱氢酶(IDH)1/2突变后会高表达, 在10–20%的AML患者、~80%的II-III级神经胶质瘤和二级GBM(多形性胶质母细胞瘤)中均能发现。最近,通过对27种人白血病细胞系、15个原发性AML样品和8种人GBM细胞系进行分析,研究者发现R-2HG 在白血病和神经胶质瘤中有着广泛的抗肿瘤活性,能降低细胞迁移率/增殖能力,增加细胞周期阻滞(cell-cycle arrest)和凋亡:
案例2: Su R, et al. Cell. 2018
研究者建立了三种动物模型,鉴定得其中2种为R-2HG敏感型;经过不同方式的R-2HG处理,敏感型小鼠的存活率显著延长;随后,研究者再对不同的白血病细胞株进行RNA-seq分析,发现FTO在敏感性细胞中的表达显著上调,并且对敏感型细胞的RNA-seq,发现MYC、G2和E2F的基因表达也会被R-2HG抑制。在机制方面,研究者通过DARTS实验、CETSAs实验和shRNA干扰证实FTO是R-2HG的直接靶点,介导R-2HG诱导的抗肿瘤作用。
研究者还对FTO相关的92个转录因子进行分析,筛选出异常高表达的CEBPA基因,高表达的CEBPA能激活FTO 启动子,而R-2HG可以使CEBPA mRNA的m6A修饰增加,降低转录稳定性,减少其表达。结合此研究结果和其他发表的文章,研究者猜测IDH突变癌症中的内源R-2HG很可能通过抑制TET2和其他表观通路促进癌症的起始。
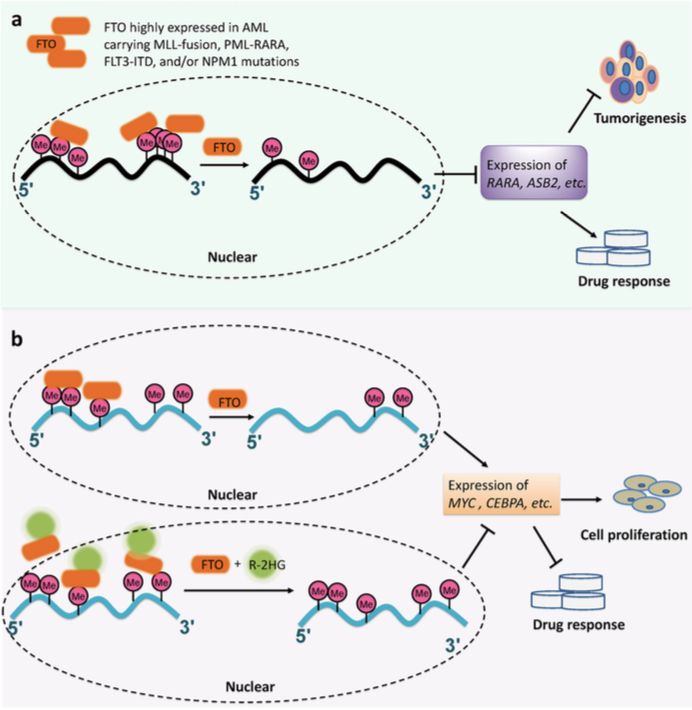
FTO作为m6A擦除器,对肿瘤起着关键的促进作用,而R-2HG可以抑制它这个功能。a, FTO与AML;b. R-2HG靶向FTO/m6A/MYC/CEBPA轴,在白血病和脑肿瘤中显示出抗癌作用。
ALKBH5与脑癌和乳腺癌
ALKBH5是第二种被发现的m6A去甲基化酶。何川和合作的研究团队发现,ALKBH5会影响mRNA的产出以及RNA代谢,通过p53信号通路调控小鼠精子发生和凋亡。在2017年底,有文章报道ALKBH5作为GBM和乳腺癌病理中的肿瘤蛋白,影响着这些肿瘤干细胞的自我更新和增殖:
案例3: Zhang S, et al. Cancer Cell. 2017
该研究发现,ALKBH5的表达在胶质瘤干细胞样细胞(GSCs)中异常上调,这种高表达与GBM患者的不良预后相关。细胞和体内实验表明,沉默ALKBH5能降低GSC细胞的自我更新能力且抑制GSC增殖/抑制肿瘤生长。随后,研究者利用meRIP鉴定m6A RNA甲基化修饰模式,联合基因芯片检测差异表达>2倍的基因,最终筛选到与胶质瘤增殖相关的转录因子FOXM1,是ALKBH5的靶基因;再通过qPCR、WB、免疫荧光、核质分离WB/qPCR、RIP和MeRIP等实验证明ALKBH5使FOXM1转录本去甲基化,增加FOXM1表达;此外,FOXM1反义lncRNA(FOXM1-AS)还能促进FOXM1与ALKBH5的相互作用。
同时也有报道称缺氧刺激HIF1α和HIF2α促进ALKBH5在缺氧的乳腺癌细胞中表达,ALKBH5高表达可通过促进m6A去甲基化,提高mRNA稳定性和NANOG的表达4。
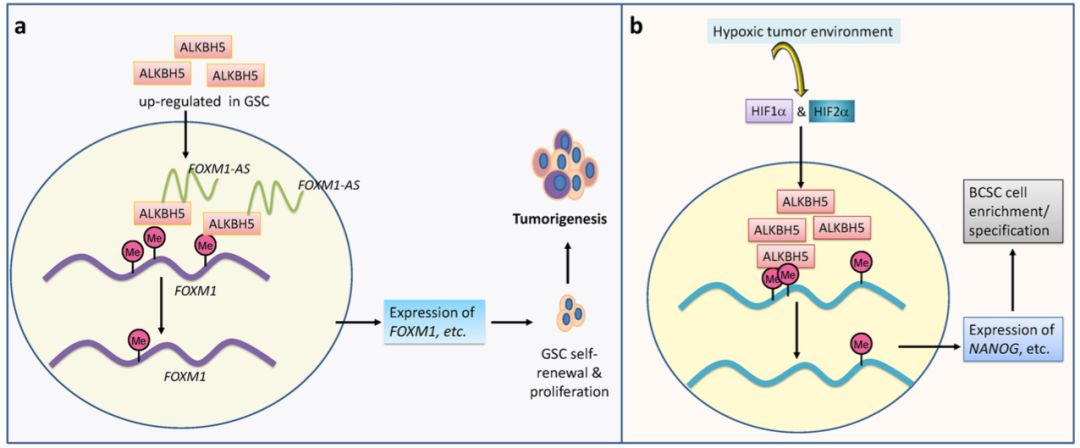
ALKBH5在脑癌和乳腺癌中起着致癌作用。a. ALKBH5增强GSC细胞的自我更新和增殖,在FOXM1-AS的帮助下,通过调控FOXM1表达,促进肿瘤发生;b. HIF诱导的ALKBH5表达,参与上调多能因子表达和BCSC在缺氧环境的富集。
METTL3/14与正常和恶性造血作用
METTL14和METTL3是m6A甲基转移酶复合体的两个主要组件。
案例5: Weng H, et al. Cell Stem Cell. 2017
研究者发现METTL14在HSPC细胞以及携带有t(11q23)、t(15;17)或者t(8;21)的AML细胞中高表达,而在髓系分化的过程中下调,敲除METTL14则会促进正常的HSPC和AML细胞终末髓系分化,并且能够抑制AML细胞的存活/增殖。在机制上,METTL14通过m6A修饰调节其靶基因(如:MYB,MYC)发挥致癌作用,并在蛋白质水平受SPI1的负调控。METTL14在AML疾病以及白血病干/起始细胞(leukemia stem/initiation cells,LSCs/LICs)的发展以及维持过程中必不可少。总之,该研究揭示了SPI1-METTL14-MYB/MYC信号轴在髓细胞和白血病中的作用,并强调了METTL14调控m6A修饰在正常和恶性造血中的关键作用。
前段时间,有报道表明METTL3控制着哺乳动物正常造血细胞和白血病细胞的髓系分化6。METTL3的表达上升,显著促进人脐带血来源的CD34+ HSPC增殖,并抑制其分化。与正常的HSPC或其他癌症相比,METLL3在AML中表达更高。
最近另一项研究也证实METTL3是维持骨髓性白血病状态的关键。Barbieri等人发现7,METTL3和METTL14均可以与染色质结合,主要定位于不同的编码基因的转录起始位点(TSSs),特征是有H3K4me3双峰。METTL3的募集,靠的是CEBPZ,即一种CCAAT-box结合因子。与启动子结合的METTL3是相关转录本m6A修饰所需的,它可以调控它们的翻译。
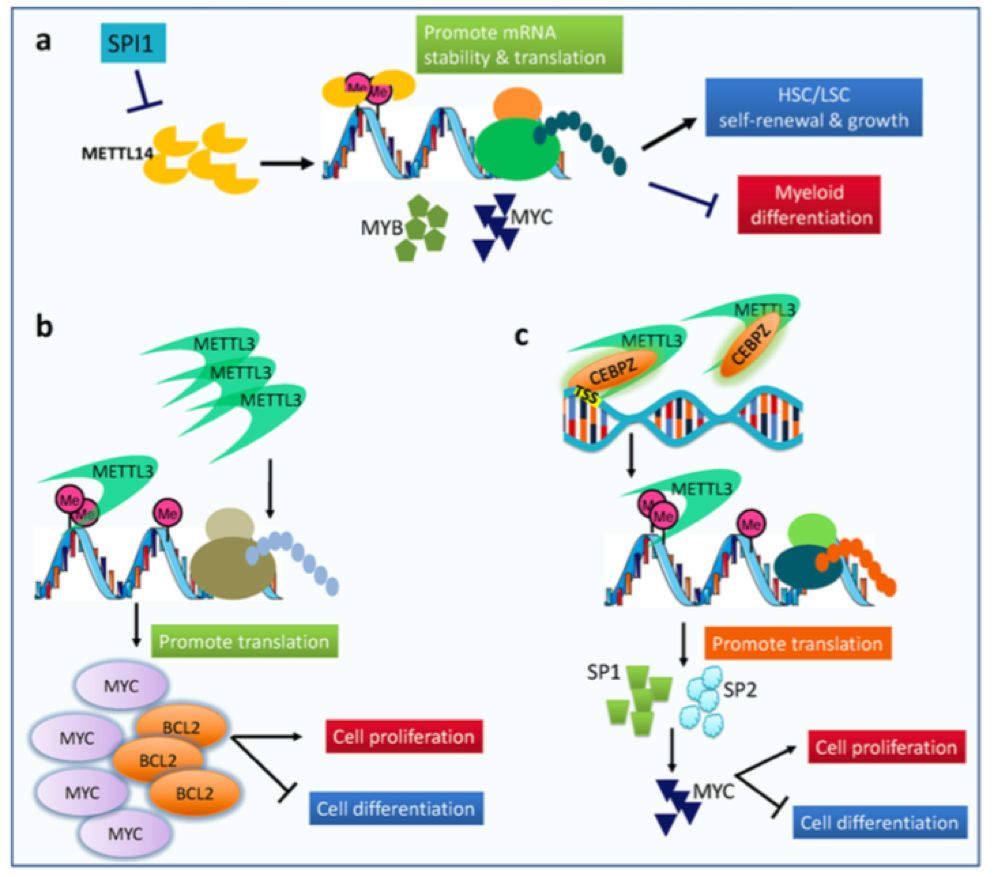
METTL14和METTL3促进白血病发生。a, METTL14在AML发展过程中是必需的,它通过m6A依赖机制,调控关键靶基因表达(如MYB和MYC);b, METTL3促进AML细胞增殖,并抑制髓系分化,这可能是通过促进潜在mRNA靶标的翻译实现的(如MYB和BCL2);c, METTL3被CEBPZ募集到靶基因的TSS,它的潜在直接靶基因是SP1和SP2,它们可调控MYC的表达。
METTL3/14与GBM和肝癌
Cui等人报道称METTL3的过表达显著促进GSC的分化8,同时抑制其自我更新和增殖,与m6A GSC分化过程中m6A水平上升的影响一致。一些GSC相关的基因是m6A修饰的特定靶基因,可通过控制m6A书写器和擦除器,影响表型。但同时也有另外一个研究团队报道了GBM的METTL3有着相反的功能9:METTL3在GSC中高表达,但是在分化的过程中下调,这与分化时m6A的水平下降有关。动物实验和GBM患者临床数据分析表明,METTL3在GSC的维持和辐射抵抗方面起着关键的致癌作用。
Ma等人报道METTL14充当着肿瘤遏制物的作用10。他们对130个HCC患者样本进行分析,发现METTL14的表达下降与患者不良预后有关。而Chen等人报道HCC中的METTL3水平和METTL14水平均比正常组织高11;对TCGA HCC的数据分析发现METTL3水平提高与患者不良预后有关。经过体内和体外实验,他们证明METTL14和METTL3在HCC的生长和转移方面起着促进作用。
METTL3与肺癌
METTL3被报道在肺腺癌中上调12,促进肺癌细胞的生长、存活与侵袭。有趣的是,这项研究表明METTL3可能作为一个在细胞质m6A阅读器,通过与翻译起始机制相互作用,促进靶标mRNA转录本的翻译。不过,METTL3的催化活性可能仍然是它促进含m6A的靶标转录本所需的,因为它的靶点在细胞质加强翻译之前,需要在细胞核中添加m6A修饰。
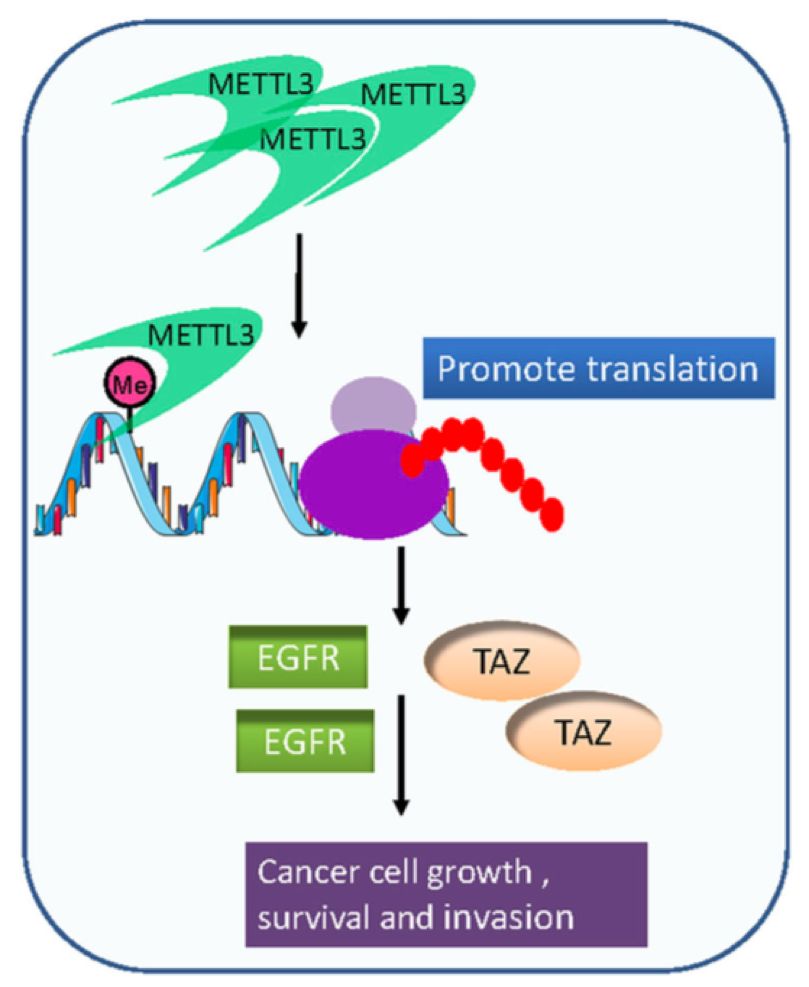
METTL3对肺癌的促进作用。METTL3通过促进靶mRNA转录本的翻译,增强肺癌细胞的生长、生存和侵袭 (如EGFR和TAZ)。
IGF2BP促进癌症发生
直到目前为止,被报道得最多的m6A读写器是YTH结构域蛋白,包括YTHDF1, YTHDF2, YTHDF3, YTDHDC1和YTHDC2。其中,YTHDF2、YTHDF3和YTHDC2促进m6A修饰mRNA的降解。有趣的是,近来研究发现白血病细胞中13,大部分mRNA转录本的m6A丰度因为FTO的过表达而显著下降,mRNA表达有下降趋势,这有可能是由于m6A丰度下降,使RNA稳定性下降。所以研究者推测,某些m6A阅读器可促进mRNA稳定性。
无独有偶,通过m6A-oligo-pull down/质谱分析和m6A结合蛋白预测分析,杨建华教授和陈建军教授合作研究团队最近证实IGF2BP1/2/3是一种新的m6A阅读器家族,可选择性识别m6A修饰(详细解读请点击此处)。
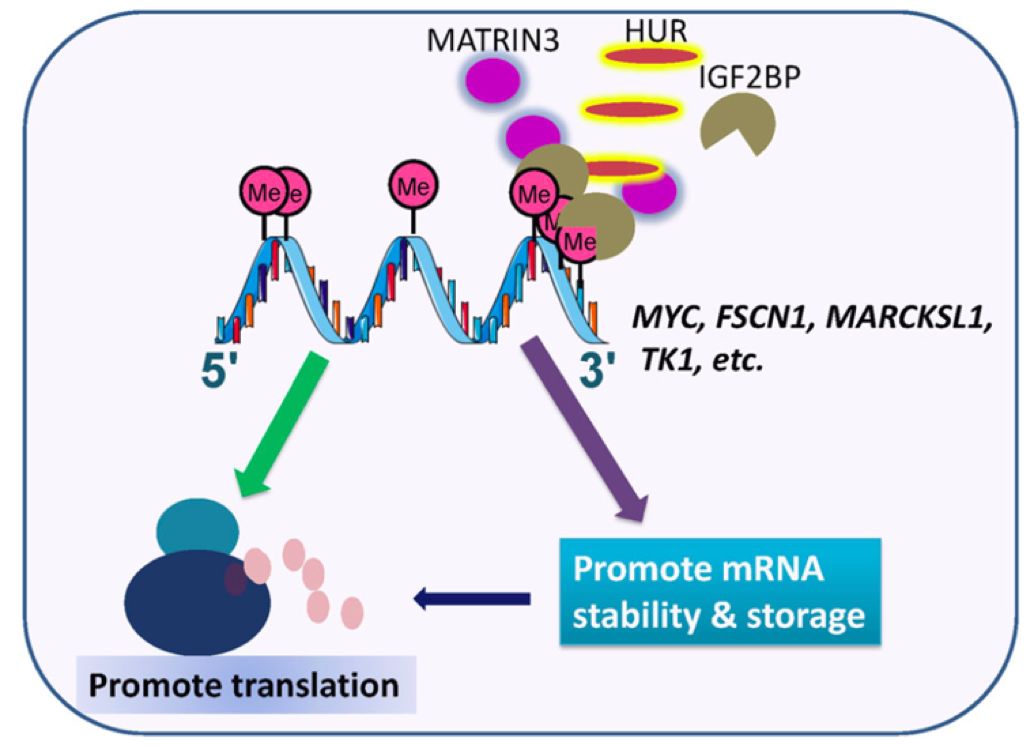
IGF2BP1/2/3蛋白促进癌症。IGF2BP1/2/3蛋白通过转录后调控关键靶mRNA的稳定性和翻译(比如MYC),促进癌症细胞增殖、迁移和侵袭。
总结
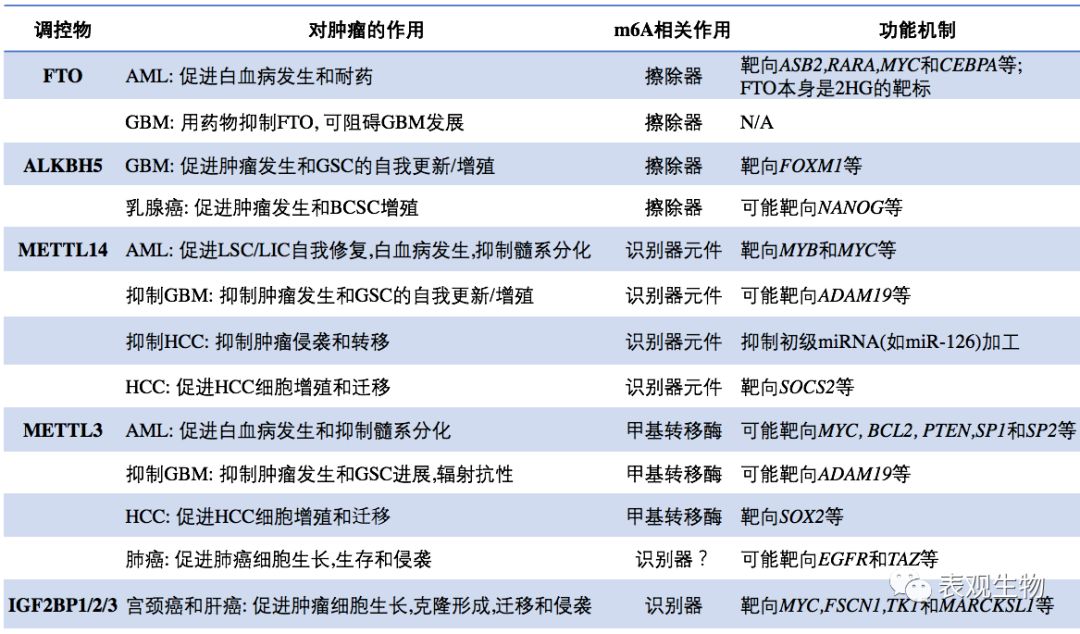
上述的m6A修饰及其相关的调控蛋白在多种肿瘤起着关键的作用新研究进展,整理如下表:
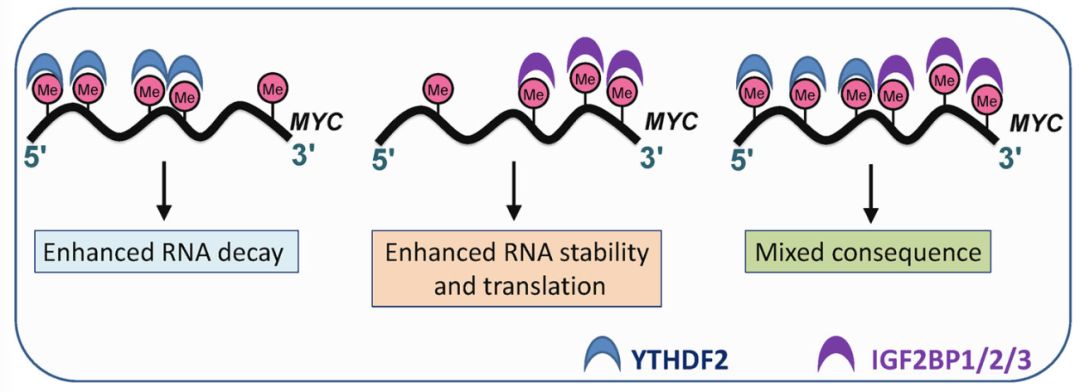
在这些研究中,IGF2BP蛋白相关研究着实是一个重大的发现:IGF2BP蛋白有选择性地识别并结合到m6A修饰的MYC mRNA CRD区域,从而稳定MYC mRNA并促进翻译;相反,YTHDF2有选择性地识别并结合到m6修饰的5’端以及MYC mRNA中间外显子,从而促进mRNA降解。
在未来的研究中,研发更多FTO及其他m6A调控蛋白的选择性抑制剂,可能有助于研发针对各种癌症的有效治疗方案。特别是将这些抑制剂和其他治疗药物联合使用,可能治疗目前对有效药物耐药的癌种。事实上,研究者已经发现R-2HG和标准治疗药物(比如ATRA、AZA、地西他滨和柔红霉素)有着协同作用。因此,研究不同癌种的不同组合用药效果是很重要的,可通过精准治疗,实现最优的治疗效果,最小的副作用。
表观生物 meRIP-seq测序服务
为客户提供详尽的RNA甲基化研究方案:
或拨打400-775-0875, 咨询QQ: 746199904
原文: Deng X, et al. RNA N6-methyladenosine modification in cancers: current status and perspectives. Cell Research (2018) 0:1–11.
参考文献:
想获得下列全部文献的读者,点击网页右侧“在线咨询”与客服联系,留下单位名称+邮箱地址,我们将把电子版发送至你邮箱
1. Li, Z. et al. FTO plays an oncogenic role in acutemyeloid leukemia as a N6-methyladenosine RNA demethylase. Cancer Cell 31,127–141 (2017).
2. Su, R. et al. R-2HG exhibits anti-tumor activity bytargeting FTO/m(6)A/MYC/ CEBPA signaling. Cell 172, 90–105 (2018). e123.
3. Zhang,S. et al. m6A demethylase ALKBH5 maintains tumorigenicity of glio- blastomastem-like cells by sustaining FOXM1 expression and cell proliferation program.Cancer Cell 31, 591–606 (2017). e596.
4. Weng, H. et al. METTL14 inhibits hematopoieticstem/progenitor differentiation and promotes leukemogenesis via mRNA m(6)Amodification. Cell Stem Cell 22, 191–205 (2018). e199.
5. Weng, H. et al. METTL14 inhibits hematopoietic stem/progenitor differentiation and promotes leukemogenesis via mRNA m(6)A modification. Cell Stem Cell 22, 191–205 (2018). e199.
6. Vu, L. P. et al. The N6-methyladenosine (m6A)-forming enzyme METTL3 controls myeloid differentiation of normal hematopoietic and leukemia cells. Nat. Med.23, 1369–1376 (2017).
7.Barbieri, I. et al. Promoter-bound METTL3 maintainsmyeloid leukaemia by m(6) A-dependent translation control. Nature 552, 126–131(2017).
8. Cui, Q. et al. m6A RNA methylation regulates theself-renewal and tumorigenesis of glioblastoma stem cells. Cell Rep. 18,2622–2634 (2017).
9. Visvanathan, A. et al. Essential role of METTL3-mediated m(6)A modification in glioma stem-like cells maintenance and radioresistance. Oncogene 37, 522–533 (2018).
10. Ma, J. Z. et al. METTL14 suppresses the metastatic potential of hepatocellular carcinoma by modulating N(6) -methyladenosine-dependent primary microRNA processing. Hepatology 65, 529–543 (2017).
11. Chen, M. et al. RNA N6-methyladenosine methyltransferase METTL3 promotes liver cancer progression through YTHDF2 dependent post-transcriptional silencing of SOCS2. Hepatology (2017).
12. Lin, S. et al. The m(6)A methyltransferase METTL3 promotes translation in human cancer cells.Mol. Cell. 62, 335–345 (2016).
13. Li, Z. et al. FTO plays an oncogenic role in acute myeloid leukemia as a N6-methyladenosine RNA demethylase. Cancer Cell 31, 127–141 (2017).
推荐阅读
● NEJM重磅综述: 表观遗传在疾病中的作用!影响因子72.40值得收藏
● NCB: 一种新的m6A阅读器!可促进mRNA翻译和稳定性
● 振奋人心的3D基因组技术:GRID-seq探索RNA-DNA相互作用
● Cell |转录调控新利器: 位点特异,远程互作,超级增强子,逐个CAPTURE!
- - - 推荐阅读 - - -

NEJM重磅综述: 表观遗传在疾病中的作用!影响因子72.40值得收藏
2018年,国际顶级医学期刊新英格兰医学杂志首次发文阐述表观遗传在疾病中的作用,你值得拥有。
2018-04-16

NCB: 一种新的m6A阅读器!可促进mRNA翻译和稳定性
m6A是在真核细胞mRNA中最普遍存在的修饰,需由阅读器(reader)识别(比如YTH结构域蛋白),调控mRNA的命运。近日,中山大学杨建华教授团队、辛辛那提大学陈建军教授以及芝加哥大学何川教授团队等合作,发现IGF2BP
2018-04-12

等了四年,miRBase 22 终于来了!
经过漫长的等待,3月13日,我们终于迎来miRBase22的官方发布了!上一次miRBase21的发布已经是2014年的事了。经过近四年的寂静,miRBase22给等待它的人带来了什么惊喜呢?快来了解一下! miRBase序
2018-03-19
