单细胞CRISPR:单细胞RNA-seq结合CRISPR筛选,多种文库选择
项目简介
CRISPR 基因编辑筛选工具已被广泛使用于生物学发现以及创新药物研发的筛选领域。CROP-seq创造性地将 CRISPR 筛选技术与单细胞 RNA-seq 技术相结合,高通量地分析gRNA对靶基因进行编辑后的单细胞转录图谱,利用高通量测序输出更多复杂的调控信息,给基因调控机制研究和药靶筛选等领域带来前所未有的变革。
技术应用与优势
技术优势
1. 采用 CRISPR 混合文库筛选(pooled screen)方法,大规模、高效筛选作用基因
2. 独特构建的 CRISPR 载体,单细胞转录组直接检测 sgRNA,大大简化筛选步骤
3. 单细胞转录组测序输出数据,信息量更大,体现复杂的基因调控图谱
技术应用
1. 高通量的基因调控功能筛选分析
2. 研究复杂的信号通路等其他生理病理过程
3. 研究复杂的细胞过程中遗传或表观遗传的调控作用4.高通量的药物靶点筛选
送样要求
1. 活细胞,细胞数量请详询 2. 冻存细胞,细胞数量请详询
样本类型
仅限人
样本物种
分析内容
基本分析
1. 原始数据质控
2. 细胞数目鉴定
3. 基因组比对
4. Counts计算
5. 双细胞过滤
6. 单细胞表达过滤
7. gRNA单细胞分配
8. PCA主成分降维
高级分析
1. 组间 gRNA 细胞表达差异基因分析
a) 组间差异基因筛选
b) 多组间差异基因筛选组间
2. gRNA 细胞表达 WGCNA 分析
a) 加权基因共表达网络模块功能富集分析
b) 加权基因共表达网络模块核心基因筛选
c) 预测基因功能
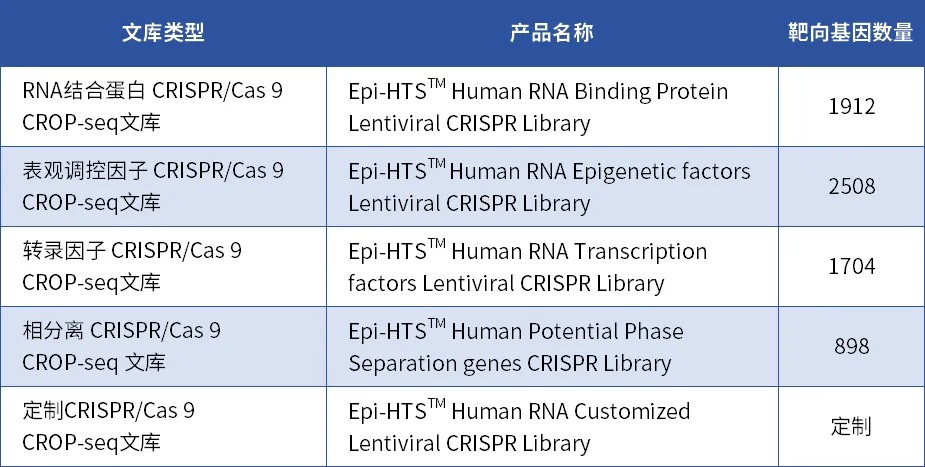
1、RNA结合蛋白CRISPR/Cas9 CROP-seq文库
此文库靶向敲除1912个RNA结合蛋白。该文库可以用于大规模筛选与RNA结合蛋白功能相关的基因,帮助研究者深入了解RNA结合蛋白在转录、翻译、RNA剪接、RNA稳定性等生物学过程中的调控作用;探索RNA结合蛋白在癌症、神经退行性疾病、免疫疾病等疾病发生发展中的作用机制,寻找新的药物靶点。
2、表观调控因子CRISPR/Cas9 CROP-seq文库
此文库靶向敲除2508个人类表观遗传基因,涵盖了多种类型的表观调控因子,包含组蛋白修饰酶、DNA甲基化酶、染色质重塑复合物和非编码RNA等。可用于研究表观遗传修饰在生物学过程中的作用,筛选疾病相关表观遗传调控因子,以及研究表观遗传药物的作用机制等。
3、转录因子CRISPR/Cas9 CROP-seq文库
此文库靶向敲除1704个人类转录因子,包括P53、MYC、OCT4、SOX2等。该文库适用于全面的功能丧失筛选研究,帮助研究者深入了解转录因子在基因调控网络中的作用,并为疾病治疗和药物研发提供新的靶点。
4、相分离CRISPR/Cas9 CROP-seq 文库
此文库靶向敲除具有高相分离潜能蛋白的898个基因。该文库可以用于大规模筛选高相分离潜能的基因功能,帮助研究者深入了解相分离在细胞内的重要生理功能以及与疾病发生发展的关系;鉴定与神经退行性疾病、癌症等疾病相关的相分离异常;筛选潜在靶点等。
5、定制CRISPR/Cas9 CROP-seq文库
表观生物支持个性化文库定制,详情咨询。
多种CRISPR/Cas9 CROP-seq文库选择
分析内容示例
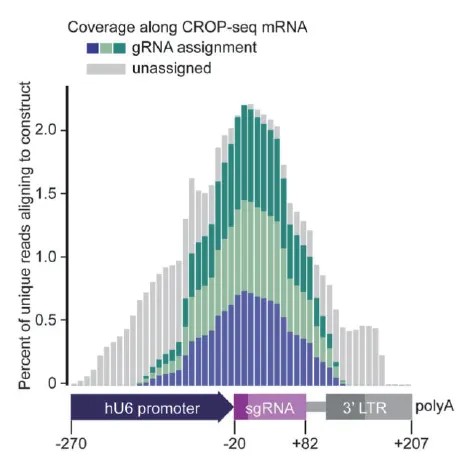
图 1. gRNA 表达分析[1]
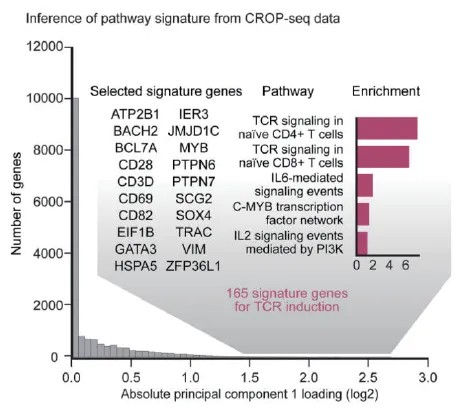
图 2. 通路标志基因富集分析[1]
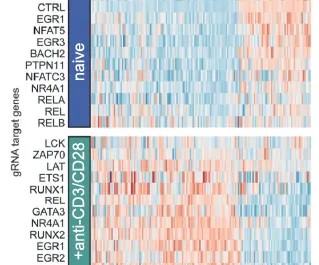
图 3. 组间 gRNA 细胞表达差异基因分析[1]
研究案例
1、Immunity:单细胞功能基因组学揭示了血癌对自然杀伤细胞的敏感性和耐药性的决定因素[2]
这项研究调查了血癌细胞对自然杀伤(NK)细胞敏感性和抵抗性的机制。研究人员使用了scRNA-seq、跨血癌细胞系组分析NK细胞敏感性的PRISM分析,以及单细胞基因筛选技术CROP-seq。他们发现NK细胞与癌细胞的相互作用会触发两种细胞类型中不同的激活状态和干扰素(IFN)状态,揭示了癌症亚型特异性NK细胞逃逸机制。其中,为了深入探究这些基因如何影响NK细胞敏感性,研究人员使用CROP-seq技术分析了基因敲除后癌细胞的转录组变化以及对NK细胞激活状态的影响。CROP-seq的数据分析结果显示,诱导抵抗性的扰动降低了NK细胞的激活,并阻止了NK细胞从静止状态转变为激活状态,而致敏扰动则诱导了更强的NK细胞激活。此外,CROP-seq鉴定出几个通过充当IFN-γ信号传导和MHC-I表达的负调节剂来调节NK细胞杀伤的基因。最后,将患者数据与CROP-seq数据整合后发现,在具有NK细胞敏感性基因突变的患者中,转录改变是一致的。
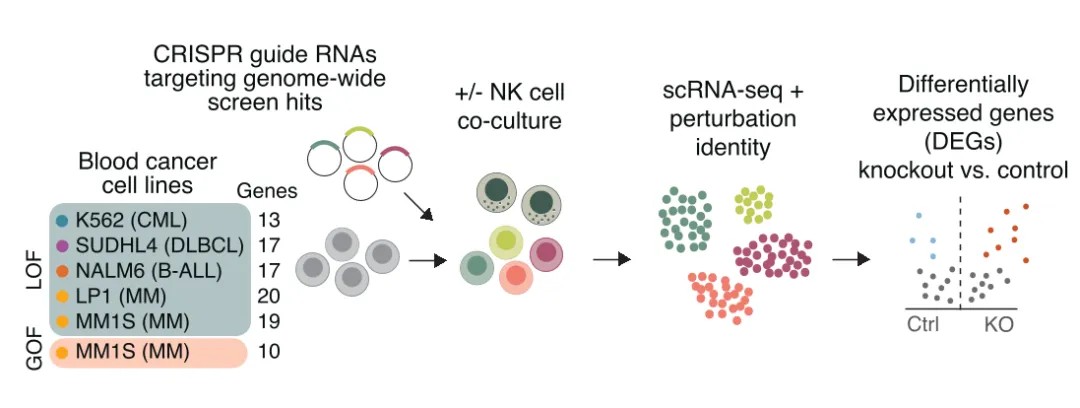
图4. CROP-seq工作流程的示意图
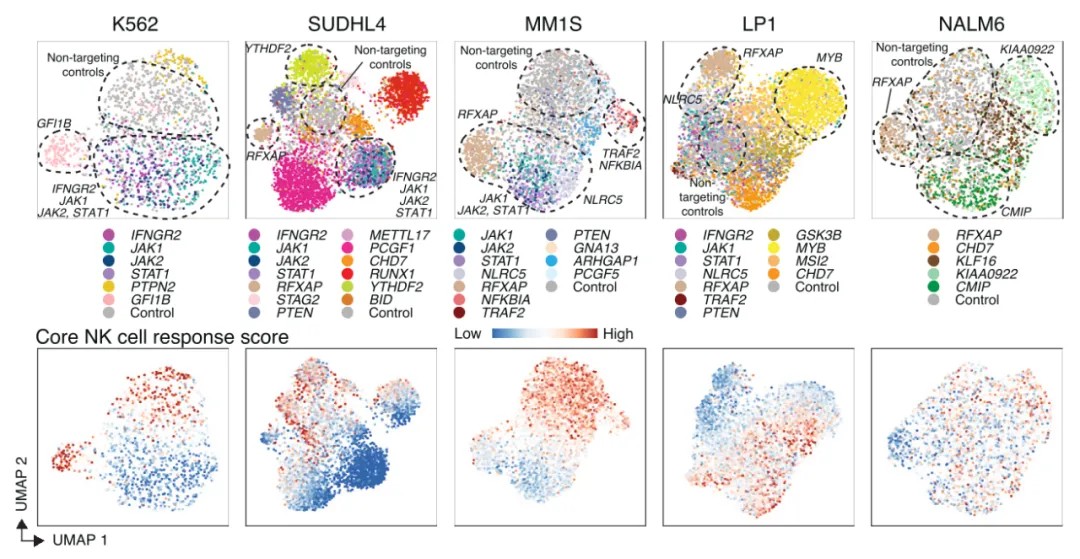
图5. 在不同细胞系中,CROP-seq数据经线性判别分析后的UMAP降维图
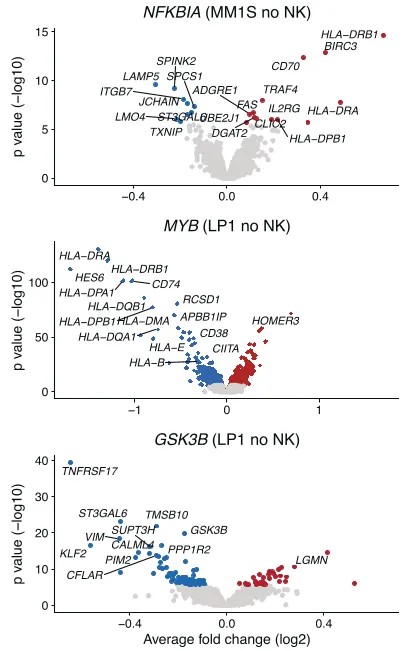
图6. 在MM1S和LP1细胞系中,差异表达基因的火山图
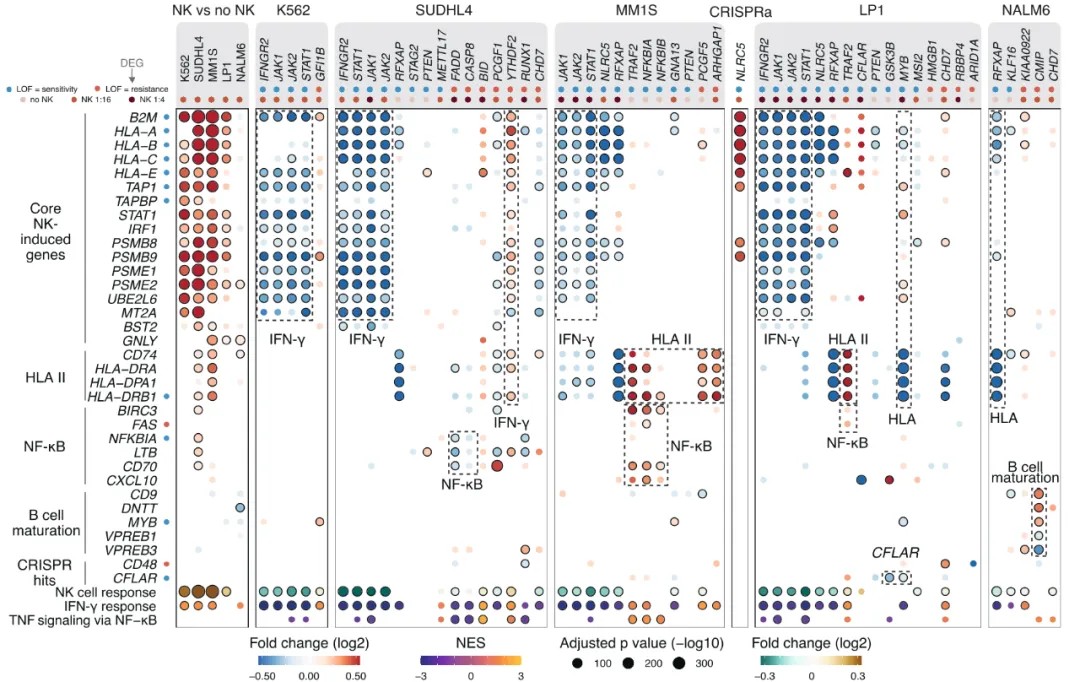
图7. 每个点代表一个基因,颜色深浅代表差异表达的程度,点的大小代表调整后p值的负对数
![2、Cell Genom:协同CROP-seq技术揭示SZ风险位点VPS45基因座中多个基因的非加性和协同作用机制[3]](http://openapi.whaleng.com/file-server/ep/2024/11/0793d92c153d4ecebaf5fab9f3620594.jpg)
图8. 展示了CROP-seq gRNAs分别靶向rs2027349和rs7148456的顺式效应
2、Cell Genom:协同CROP-seq技术揭示SZ风险位点VPS45基因座中多个基因的非加性和协同作用机制[3]
这篇文章描述了一个关于精神分裂症(SZ)的GWAS风险位点在人类神经元中如何影响突触发育和功能的研究。研究者们使用hiPSC来源的,以及NEUROG2诱导分化的兴奋性神经元(NGN2-Glut)作为神经发育模型,并结合了ATAC-seq, RNA-seq以及CROP-seq技术来研究SNP rs2027349的功能。通过ATAC-seq,他们发现rs2027349位点在NGN2-Glut神经元中表现出强烈的ASoC(allele-specific open chromatin)现象。进一步使用CROP-seq结合scRNA-seq技术,研究者们确认了rs2027349附近的序列具有调控基因表达的潜力,并发现了三个受rs2027349调控的基因:VPS45、AC244033.2(IncRNA)和C1orf54。后继的基因敲低和功能实验表明,这三个基因以非加性和协同的方式影响神经元的表型变化,并可能与SZ和其他神经精神疾病相关。
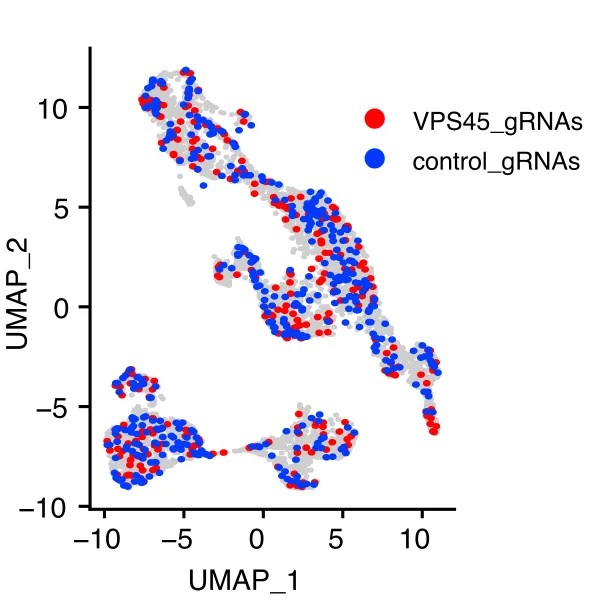
图9. UMAP图,根据细胞中不同gRNA的表达将细胞进行了分类
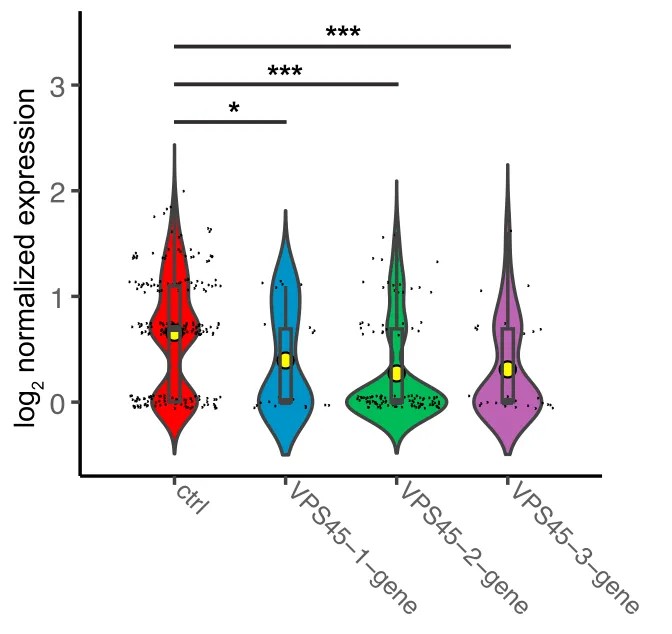
图10. VPS45 gRNAs对VPS45基因表达水平的影响
参考文献
[1] Datlinger P, Rendeiro AF, Schmidl C, et al. Pooled CRISPR screening with single-cell transcriptome readout. Nat Methods 2017 03;14(3).
[2] Dufva O, Gandolfi S, Huuhtanen J, et al. Single-cell functional genomics reveals determinants of sensitivity and resistance to natural killer cells in blood cancers. Immunity. 2023;56(12):2816-2835.e13.
[3] Zhang S, Zhang H, Forrest MP, et al. Multiple genes in a single GWAS risk locus synergistically mediate aberrant synaptic development and function in human neurons. Cell Genom. 2023;3(9):100399. Published 2023 Aug 28.
