2019年第一季度CNS表观遗传文章盘点
表观遗传指在DNA序列不改变的情况下,发生可遗传的基因表达改变[1]。研究表明,表观遗传调控的异常与生长发育和疾病,特别是癌症的发生发展息息相关。近年来,表观遗传成为生命科学领域的研究前沿和热点。
经典的表观遗传调控主要包括4个方面[2.3]:DNA甲基化修饰,组蛋白共价修饰,组蛋白非共价修饰和miRNA等非编码RNA介导的表观遗传调控。
近年来,随着对转录组修饰,特别是mRNA上m6A修饰的关注,芝加哥大学的何川教授提出“RNA表观遗传学(RNA epigenetics)”概念。该概念的提出,丰富了中心法则,也提高了RNA的地位。但也有学者认为就目前的研究而言,提出该概念为时尚早[4]。
2019年第一季度已过,Cell,Nature和Science(简称CNS)等顶级期刊发表了多篇表观遗传研究,Anna从中选取8篇,分享给大家!

1. Nature:
表观转录组与表观蛋白组存在crosstalk
m6A,指RNA上N6-甲基腺嘌呤(N6-methyladenosine)修饰,是近几年RNA研究领域的大热门。相信大家也阅读过很多m6A在癌症中功能的研究,并了解相关研究套路(点击此处回顾m6A研究套路),然而,就是这样隔三岔五就有“大动作”的m6A,其最基本的几个生物学问题,却一直无人问津。
大量m6A测序发现,m6A主要存在于mRNA的3’UTR区,其保守的修饰motif为RRACH(R表示G或A,H表示A,C或U),但并不是所有具有该motif的RNA都会带上m6A修饰,因此,关于m6A是如何实现对RNA的选择,以及为什么富集在3’UTR区,一直是关键的亟待解决的科学问题。
3月14日,美国希望之城国家医疗中心的陈建军教授联合中山大学杨建华教授,芝加哥大学何川教授和辛辛那提儿童医院黄刚教授在Nature发表了一项研究,创造性的发现RNA表观遗传与组蛋白表观遗传存在cross talk:组蛋白H3K36me3修饰在转录水平引导RNA m6A修饰[5]。
该文的前言也并没有太多的介绍,不清楚研究者最初是如何想到将组蛋白修饰与RNA修饰联系在一起的(可能是科学研究中的大胆与意外吧),但是研究者系统的分析了9种常见的组蛋白修饰与m6A的相关性,并惊讶的发现H3K36me3修饰与m6A的具有很高的相关性:
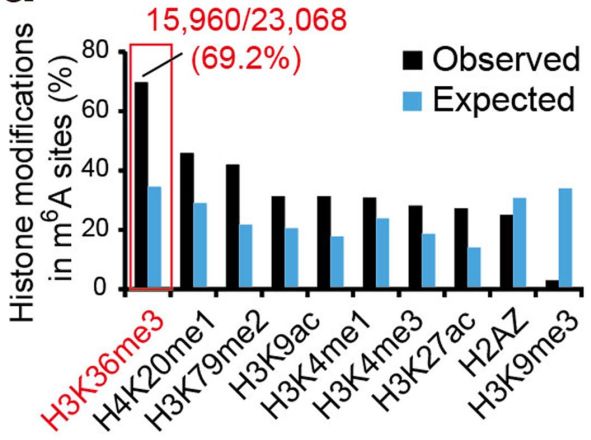
图1
进一步,研究者发现敲低或过表达H3K36me3可抑制或促进m6A修饰,并且m6A甲基化酶复合体(由METTL3,METTL14和WTAP组成)中的METTL14能直接识别H3K36me3:
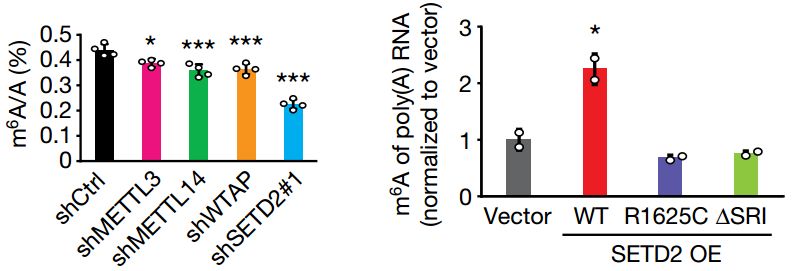
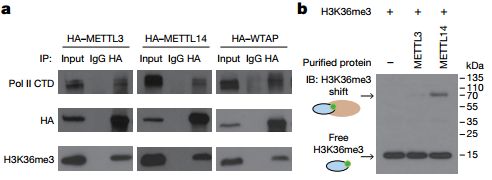
图2
基于此,研究者提出以下m6A甲基化酶选择RNA进行催化的作用模型(图3)。组蛋白H3K36me3是主要位于基因3’端的修饰,METTL14结合H3K36me3后将m6A甲基化酶复合体也带到基因的3’端,当RNA聚合酶II(pol II)转录新生RNA时,m6A甲基化酶复合体对该RNA进行甲基化修饰,因此,m6A主要富集在3UTR,并且对RNA具有选择性。
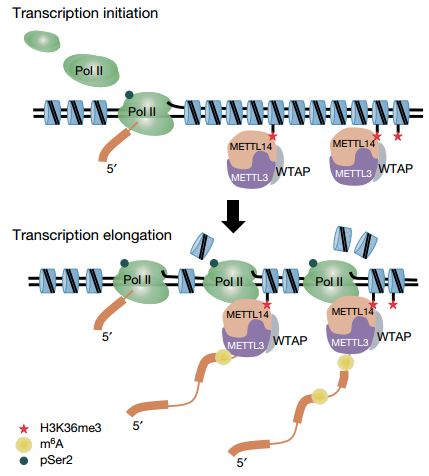
图3
该研究首次发现组蛋白修饰与RNA修饰之间的联系,使得RNA表观遗传不再是一个孤岛,同时回答了m6A选择性这个重要的科学问题,对整个RNA表观遗传研究具有重要意义。

2. 同期3篇Science:
组蛋白去甲基化酶可直接感应氧气浓度
大约在26亿年前,由细菌光合作用产生的副产物——氧气进入地球大气层。氧气的产生,使得依赖氧气作为高效燃料代谢的多细胞生物崛起,是生物进化上的大事件。关于生物体如何感应氧气,大部分研究集中在包括HIF在内的氧气感应蛋白上。这些蛋白需要氧气分子,铁元素和2-酮戊二酸作为辅助因子,完成氧化还原过程。含有Jumonji-C结构域的组蛋白去甲基化酶家族也属于此类蛋白,但是关于它们是否能直接感应氧气的浓度,还未见有报道。
在3月15日发表的Science中,来自英国利物浦大学的SoniaRocha教授和美国哈佛医学院的William G. Kaelin Jr教授发表背靠背研究[6.7],共同关注组蛋白去甲基化酶对氧气的感应,同期还配了英国剑桥医学院Brian J. P. Huntly教授的评论[8],可见该研究的意义重大。
利用质谱检测,研究者发现在低氧状态下,一系列的组蛋白修饰都发生了变化:
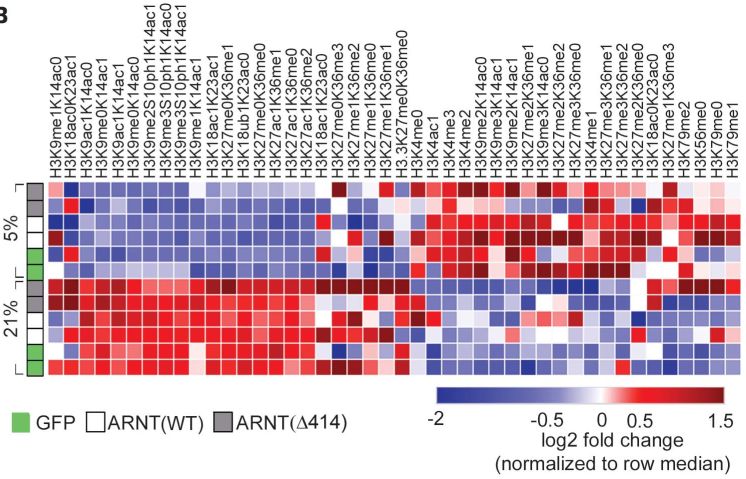
图4
有趣的是,两个研究组分别发现激活性组蛋白修饰H3K4me3和抑制性组蛋白修饰H3K37me3的去甲基化酶:KDM5A和KDM6A,可以直接感应氧气浓度的变化。
正如Brian J. P. Huntly在评论中绘制的作用机制图(图5),在正常氧气浓度下,HIF经泛素化修饰,由蛋白酶体降解。而在低氧浓度下,HIF保持稳定并进入细胞核作为转录因子发挥功能,同时,KDM5A和KDM6A感应到氧气浓度下降,它们的活性也降低,分别导致组蛋白H3K4me3和H3K37me3修饰上升,激活和抑制靶基因的表达,影响胚胎发育,干细胞稳态等生命过程。
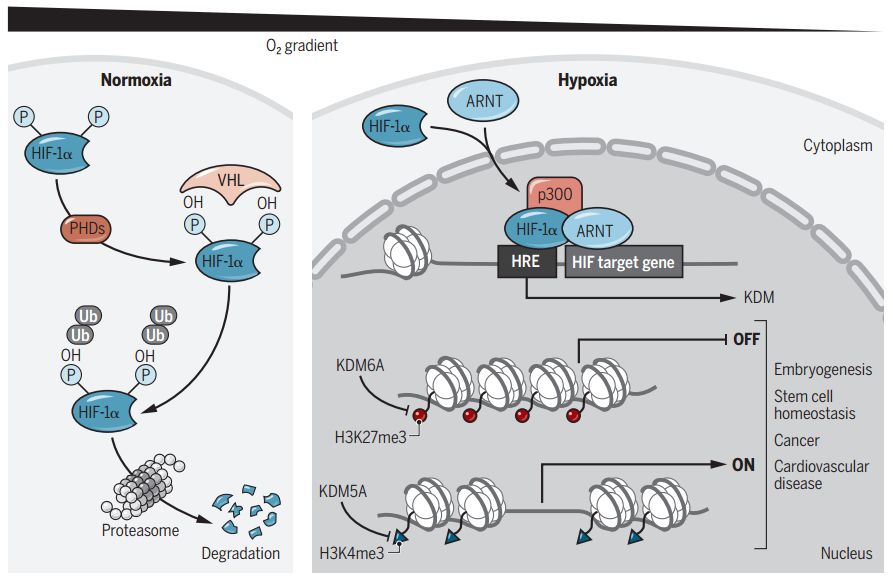
图5
此外,由于肿瘤细胞的快速增殖导致氧气的供应不足,低氧通路的异常激活已成为癌细胞的特征之一。该通路中最重要的HIF因子得到了大量的关注,HIF抑制剂也有望应用于癌症的临床治疗。而两项SCIENCE研究证明组蛋白去甲基化酶可独立于HIF,自行感应氧气的浓度发挥功能,这提示单一靶向HIF可能不足以掐断应对低氧的信号通路,未来针对KDM5A和KDM6A涉及的激活剂,或许能与HIF抑制剂联合使用。
值得注意的是,m6A去甲基化酶,FTO和ALKBH5也属于依赖氧气的氧化还原酶,那么它们是否也能直接感应氧气浓度,从而在低氧条件下影响癌细胞的生长呢?这个疑问还有待进一步的探究。

3. Nature:
首次发现组蛋白存在血清素修饰
组蛋白八聚体(H2A, H2B, H3和H4各两个)是核小体的核心部分,它们可发生乙酰化,甲基化,磷酸化,泛素化和SUMO化等共价修饰调控基因的表达。
而在3月28日的Nature上,来自纽约西奈山医学院的IanMaze教授发表的研究首次报道了一种全新的组蛋白修饰类型——组蛋白血清素修饰[9]。该修饰能促进H3K4me3介导的基因转录激活。
血清素(serotonylation),也称为5-羟色胺(5-HT),是一种常见的神经递质,用于大脑神经元间的信号传递,与人的胃口,食欲,睡眠和情绪相关。虽然包裹在突触小泡中对血清素发挥功能至关重要,但也有研究在发现血清素存在于小泡之外。而目前对此类血清素的研究还未见有报道。
研究发现血清素可通过TGM2(transglutaminase2,谷氨酰胺转氨酶2)与细胞质蛋白形成共价结构,而TGM2可能与组蛋白互作,那么血清素是否能共价结合组蛋白,形成新的组蛋白修饰呢?
为了回答这个问题,研究者使用生物代谢标签的方法,将血清素变成5-PT (propargylatedserotonin)使其能够被生物素标记的磁珠捕获。通过IP验证,发现血清素与H3结合,而不与其他组蛋白结合:
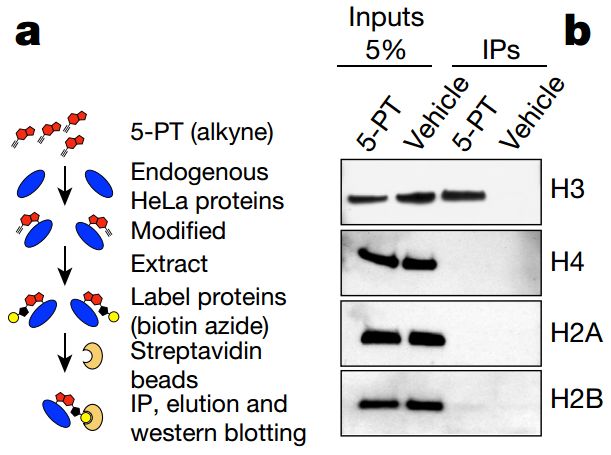
图6
那么血清素是与H3的哪个氨基酸结合,又发挥了什么生物学功能呢?进一步的研究显示,血清素主要结合在H3第5号位的谷氨酰胺上,形成H3Q5ser。看到这,大家可能很快就想到了激活性组蛋白修饰H3K4me3,从位置上看这两个修饰是紧挨着的,那么,它们是否协同发挥作用呢?
确实,研究者发现TGM2介导的是具有H3K4me3修饰的H3的H3Q5ser修饰,也就是说H3Q5ser存在的前提是H3K4me3的存在,并且,更为重要的是H3Q5ser促进转录因子TFIID对H3K4me3的阅读,促进其修饰基因的转录:

图7
H3Q5ser在神经细胞分化过程中升高,过表达不能被血清素修饰的H3后,细胞分化受阻,提示H3Q5ser在分化进程中具有重要的生理意义。
该研究不仅鉴定了新型组蛋白修饰,同时为解释血清素参与的情绪障碍,药物成瘾和神经退行疾病等生物过程提供了新的思路。

4. Cell:
组蛋白H3K79修饰需要H2B-Ub和H4的帮助
组蛋白上具有数量众多的修饰,关于这么修饰间是否存在cross talk一直是表观遗传学研究的热点。正如我们上文提到的,H3Q5ser促进H3K4me3靶基因的转录,就属于两个修饰间的cross talk。DOTL1是目前鉴定的唯一H3K79甲基转移酶(注意,目前尚未鉴定到H3K79去甲基酶),而DOT1L蛋白对H3K79的甲基化依赖H2B K120ub,这已成为组蛋白修饰间cross talk的经典例子。然而,关于H2B-Ub促进DOT1L的具体机制,尚不清楚。3月7日,来自约翰霍普金斯医学院的Cynthia Wolberger教授在Cell发表研究[10],从结构生物学的角度详细阐述了H2B-Ub促进DOT1L的具体机制。
绝大部分组蛋白修饰都存在于组蛋白各亚基的“尾巴”上(图8),这可能是为了让相关催化酶更好的结合该位点的氨基酸。然而,H3K79却位于组蛋白的球体区域,那么,DOT1L是如何接近H3K79的呢?
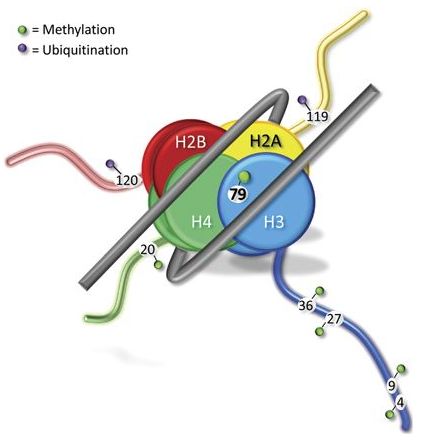
图8[11]
研究者发现,DOTL1通过识别结合H2B ub修饰的核小体,使其处于“准备”催化的状态,而只有当H4的尾巴(tail)结合了DOT1氨基端的缝隙(cleft),DOT1L才能接触H3K79,并完成甲基转移酶的催化过程:
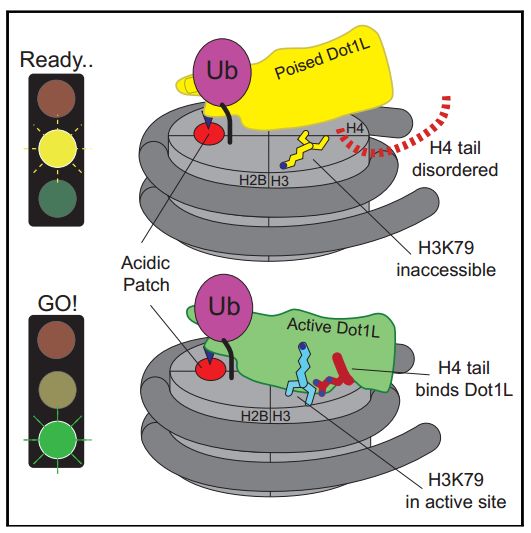
图9
结构生物学的研究为分子生物学的成果提供了“眼见为实”的证据,由此,我们才能全面了解DOT1L介导的H3K79me的修饰过程。

5. Nature:
组蛋白突变了,组蛋白修饰咋办?
组蛋白修饰在生长发育和疾病中的重要性不言而喻。癌细胞由于基因组不稳定,往往伴随着许多基因突变,近年来的研究发现,除了组蛋白修饰酶的异常表达,癌细胞甚至会突变相关组蛋白的氨基酸,以达到抑制某种组蛋白修饰的效果。比如在78%的胶质瘤(intrinsic pontine gliomas)病人中,存在H3蛋白第27位赖氨酸(K)突变为蛋氨酸(M)的情况,该突变直接造成抑制性组蛋白修饰H3K27me的缺失,促进了癌症的发生发展。由此可见,组蛋白突变,特别是相关修饰位点的氨基酸突变,在癌症中扮演重要角色。然而,目前还没有研究系统的分析癌症中组蛋白的突变情况。在3月20日的Nature中,来自纪念斯隆凯特灵癌症中心的C. David Allis教授发表的这项研究是目前最全面的癌症组蛋白研究[12]。
研究者分析了TCGA中183类癌症的3074位患者的测序数据,鉴定了组蛋白上4205个错义突变,根据最保守的估计,组蛋白在癌症中存在4%的突变率。这些突变可以发生在组蛋白的“尾巴”和球状体区域,并且部分突变在酵母中也是保守的,能影响核小体的功能,部分突变的氨基酸具有修饰。该研究提示,在研究组蛋白表观遗传变化时,不仅要考虑相关催化酶的变化,还要考虑组蛋白本身的突变,因为组蛋白突变也会造成基因表达的异常,引发癌症(图16)。
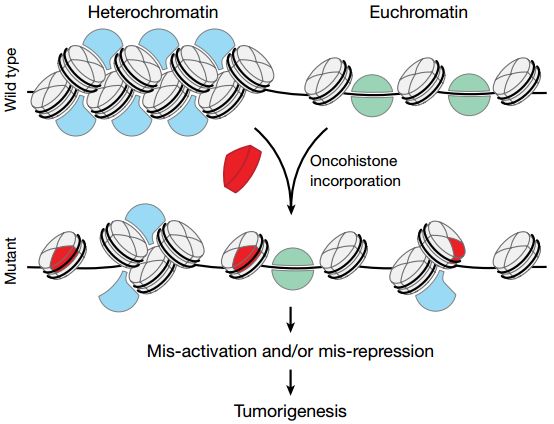
图10
文献解读到此,我们可以看出,表观遗传间的crosstalk是该领域的研究重点和热点,同时,新的修饰类型的鉴定也是前言领域。这两项研究的推进,为研究癌症中表达遗传学异常打下了基础。未来我们也期待更多更好的研究,能够将表观遗传学的研究成果真正应用于癌症的临床治疗。
参考文献
[1] Rice JC, Allis CD. Histone methylationversus histone acetylation: new insights into epigenetic regulation [J].CurrOpin Cell Biology, 2001, 13(3):263-273
[2] Sharma S, Kelly TK, Jones PA. Epigeneticsin cancer[J].Carcinogenesis, 2010, 31 (1) :27-36
[3] Kouzarides T.Chromatin modifications andtheir function [J].Cell, 2007, 128 (4) :693-705
[4] Darnell, R. B., Ke, S., & Darnell,J. E. (2017). pre-mRNA processing includes N6 methylation of adenosine residuesthat are retained in mRNA exons and the fallacy of" RNA epigenetics".RNA, rna-065219
[5] Huang H, Weng H, Zhou K, et al. Histone H3 trimethylation at lysine 36 guides m6A RNA modification co-transcriptionally. Nature. 2019 Mar;567(7748):414-419.
[6] Batie M, Frost J, Frost M, et al. Hypoxia induces rapid changes to histone methylation and reprograms chromatin. Science. 2019 Mar 15;363(6432):1222-1226.
[7] Chakraborty AA, Laukka T, Myllykoski M, et al. Histone demethylase KDM6A directly senses oxygen to control chromatin and cell fate. Science. 2019 Mar 15;363(6432):1217-1222.
[8] Gallipoli P, Huntly BJP. Histone modifiers are oxygen sensors. Science. 2019 Mar 15;363(6432):1148-1149.
[9] Farrelly LA, Thompson RE, Zhao S, et al. Histone serotonylation is a permissive modification that enhances TFIID binding to H3K4me3. Nature. 2019 Mar;567(7749):535-539.
[10] Worden EJ, Hoffmann NA, Hicks CW, et al. Mechanism of Cross-talk between H2B Ubiquitination and H3 Methylation by Dot1L. Cell. 2019 Mar 7;176(6):1490-1501.e12.
[11] CM McLean, ID Karemaker and F vanLeeuwen, The emerging roles of DOT1L in leukemia and normal development, Leukemia(2014) 28, 2131–2138.
[12] Nacev BA, Feng L, Bagert JD, et al. The expanding landscape of 'oncohistone' mutations in human cancers. Nature. 2019 Mar;567(7749):473-478.
- - - 推荐阅读 - - -
m6A正火,ac4C又至!详解Cell最新ac4C研究
表观转录组(epitranscriptome)可谓近年来最火热的研究领域。其中,m6A也成为仅凭一己之力,带动整个领域发展的最具价值研究对象! 早在1974年,Desrosiers[1]和Perry&Kelley[2]课
2019-04-01

年度大盘点| 2018外泌体重量级研究一览,看这篇就够了
年度大盘点|2018外泌体重量级研究一览,看这篇就够了 原创:Epi老师表观生物 刚过去的2018年,也是外泌体研究热度持续升温的一年,在多个领域均涌现了重大的研究进展。久等了!2018外泌体研究盘点
2019-02-26
专家解读Cell丨mRNA乙酰化修饰的重要发现与生物学意义
解读丨李笑雨、伊成器(北京大学生命科学学院) 责编丨迦溆 当前研究已经在RNA上发现了超过100种不同类型的转录后修饰【1】,这些修饰大部分分布在rRNA、tRNA等高丰度的ncRNA上,并且对这
2019-02-16
