趣谈exo| 特洛伊-外泌体假说 The Trojan Exosomes Hypothesis
相信exosomes研究者们,都接触过一个有趣的词:“特洛伊外泌体”。为什么外泌体会和古希腊的著名战争有关系?今天Epi老师来跟大家科普一下。
1 The Trojan Exosomes Hypothesis
在古希腊传说中,希腊联军围困特洛伊久攻不下,于是假装撤退,留下一具巨大的中空木马,特洛伊守军不知是计,把木马运进城中作为战利品。夜深人静之际,木马腹中躲藏的希腊士兵打开城门,特洛伊沦陷。
提到特洛伊木马,比起那场战争,咱们更容易想到的是电脑病毒。exosomes与特洛伊的渊源,还真的跟病毒有关系。
早在2003年,主要研究HIV病毒的Gould和Hildreth,就提出了“特洛伊外泌体假说”(The Trojan exosomes hypothesis)1。这个假说提出,逆转录病毒 (retroviruses) 利用细胞间囊泡通讯、exosomes的运输,生成逆转录病毒粒子,并作主要的侵染活动。利用Trojan exosomes假说,就能够很好地解释逆转录病毒的一些特征:逆转录病毒特有的脂质组分是如何进行传播的,宿主细胞的蛋白为什么会出现在逆转录病毒粒子中,逆转录病毒释放的复杂细胞生物过程,以及逆转录病毒为何在没有包膜蛋白、没有受体的情况下,还能够感染细胞。不光如此,Trojan exosomes假说还有一个更大胆的假设:逆转录病毒正是从exosomes演变而来的(exosomal origin)!所以在2003年,Gould就根据这个假说预测说:逆转录病毒就是适应性免疫应答的一个悖论,逆转录病毒抗体疫苗不能提供预防保护,自身免疫才是抗逆转录病毒免疫的关键。
15年后的今天,针对最广为人知的逆转录病毒——HIV的成熟疫苗仍未面世。多个艾滋病疫苗,都被扼杀于临床试验阶段。如默克公司的MRK Ad5方案,通过了前期测试,但是在大规模研究中显示,会增加受试者 HIV 感染风险,最终在2007年宣告失败2;又如RV-144疫苗,这种疫苗由美国和泰国联合研究,从2003年开始实施,2009年宣布了实验结果:降低了31%的艾滋病感染风险3。这个结果当然不能令人满意,但已经是至今为止,距离成功最近、走的路程最远的一次了。目前强生公司的HIV疫苗试验已顺利完成II早期试验,给我们种下一颗希望的种子。
所以在上个月,Hildreth本人也在Front Immunol上发文重提了当年的Trojan exosomes假说4。他指出,把HIV当作exosomes来研究,或许是研发HIV疫苗的一个好办法。
2 Exosomes与逆转录病毒
那么这个大胆的假说具体怎么说的呢?首先,exosomes与逆转录病毒的相似点多得真的有点过分:
1. 形态学和生理学:形态上,exosomes和逆转录病毒是相似的颗粒,双层脂膜,直径为100~200 nm;生理学上,两者的胆固醇、糖鞘脂都比细胞质膜高5.6;HIV-1和T细胞分泌的exosomes,都有多糖外衣7,也有一样的质膜蛋白 (如tetraspanins, 补体, MHC),胞浆蛋白 (actin, tsg101, 热休克蛋白)8、宿主蛋白9。感染HIV病毒后,细胞分泌出来的exosomes,也整合有病毒蛋白,比如Nef蛋白通过exosomes转运10。
2. 形成和释放途径:exosomes和HIV都可通过MVB(即多泡体,也是一种晚期内体)途径,借助ESCRT机制生成和释放。
3. 传播途径:exosomes可通过内吞途径被受体细胞吸收,这个过程中会发生细胞受体、ICAM1、脂酰丝氨酸以及其他exosomes表面分子的相互作用11;而在HIV-1出芽时,也会整合进宿主的ICAM112,脂酰丝氨酸也在HIV-1侵染单核细胞时发挥着作用。来源于DC细胞的exosomes有着免疫作用,携带抗原的exosomes能刺激抗体特异性CD4+ T细胞和CD8+T细胞激活8;相似地,DC细胞可以不依赖包膜的途径捕获HIV,随后HIV可以向CD4+ T细胞和CD8+T细胞呈递抗原13。
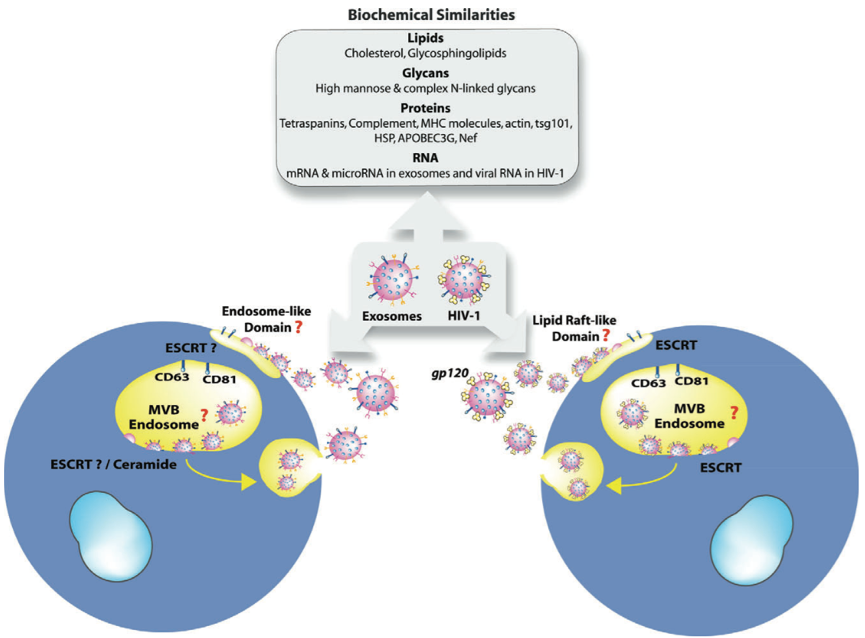
Exosomes与HIV在生化组分、形成和释放方面的相同点
有鉴于此,Gould提出,逆转录病毒在进化过程中,发展出了利用宿主细胞固有的exosomes形成和释放途径,产生感染性病毒颗粒;利用MVB进行生成和释放的能力,从而逃避宿主免疫;利用exosomes被受体细胞吸收的途径,形成不依赖于包膜蛋白的、非受体介导的感染模式,感染其他细胞。这个假说当年从全新的角度诠释了逆转录病毒的进化、生物起源、感染和传播的机制,较为合理地揭示了逆转录病毒一些重要的生理学和免疫学特性。
也就是说,病毒“挟持”了exosomes,利用它进入了宿主细胞、敌人内部,exosomes就如同那只木马,大摇大摆地进了城门,而病毒的分子,如mRNA (HCV的RNA14、HIV的Gag15)、miRNA (EBV的miRNA16)、蛋白 (HIV的Nef10) 甚至是整个病毒粒子 (HCV),在exosomes的掩护下顺利进入宿主细胞后,就从exosomes释放出来,发挥功能,协助病毒侵染、复制,宿主细胞沦陷。现在,越来越多的证据支撑了这个假说,所以特洛伊外泌体这个名词出现得也越来越频繁,广为人知了。
而至于假说中提到的另一个更大胆的假设:exosomes就是逆转录病毒的祖先,逆转病毒正是由exosomes进化而来的,这一点目前我们就不得而知了。想必Izquierdo-Useros对此也感到困惑,不然也不会给他的综述起这样的题目: Exosomes and retroviruses: the chicken or the egg?
3 Cell: 逆转录病毒样蛋白与EV
以上就是exosomes被比喻为Trojan horse的由来。为什么Epi老师突然给大家讲这个?因为上周Cell 同期发布了两篇EV与逆转录病毒蛋白Gag类似的Arc蛋白研究。不要小看逆转录病毒和转座子,这些蛋白和我们是息息相关的。有人这么描述转座子:基因组从出现就一直在经历一场和转座子及逆转录病毒的战争。真核生物的基因组到处是这场战争留下的疤痕,比如人类的基因组有45%的序列都跟转座子有关,且其中大部分转座子来源的基因都在大脑表达。
这两项研究的对象都是神经元基因Arc,它与突触的可塑性以及CNS疾病相关,比如阿兹海默病、精神分裂症等。Arc与逆转录病毒Gag样蛋白有着类似的结构域,进化上同源。其中一篇Cell 来自于美国犹他大学的Pastuzyn等人17,研究主要使用HEK细胞、小鼠模型来源的原代神经元细胞,发现Arc蛋白通过EV从神经元细胞中释放;除了Arc蛋白,EV同时也可以将Arc mRNA转运到另一个细胞,并在这个细胞内翻译表达,表明Arc就像逆转录病毒的Gag蛋白,还能整合进病毒样衣壳中; Gag逆转录因子在进化过程中被重新用于神经系统中的细胞间通讯。
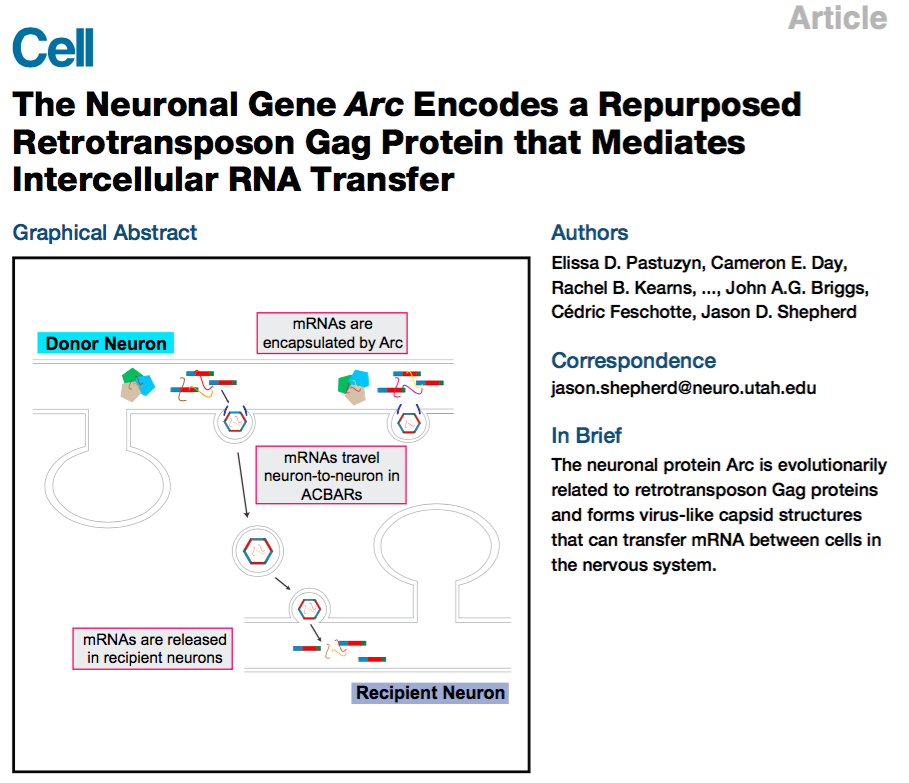
神经元基因Arc编码类似逆转录转座子Gag的蛋白,介导RNA胞间转运
来自于马萨诸塞大学医学院的Ashley等人18研究的是果蝇的Arc1蛋白,同样可构成衣壳样结构,它和darc1 mRNA一起转载到EV,从运动神经元转运到肌肉,有意思的是,为什么EV不仅转运发挥功能的蛋白,还要转运它的mRNA?Ashley发现,EV对Arc1的转运依赖于darc1-mRNA3'非翻译区,它含有逆转录转座子样序列,中断这个转运的话,会破坏突触的可塑性。
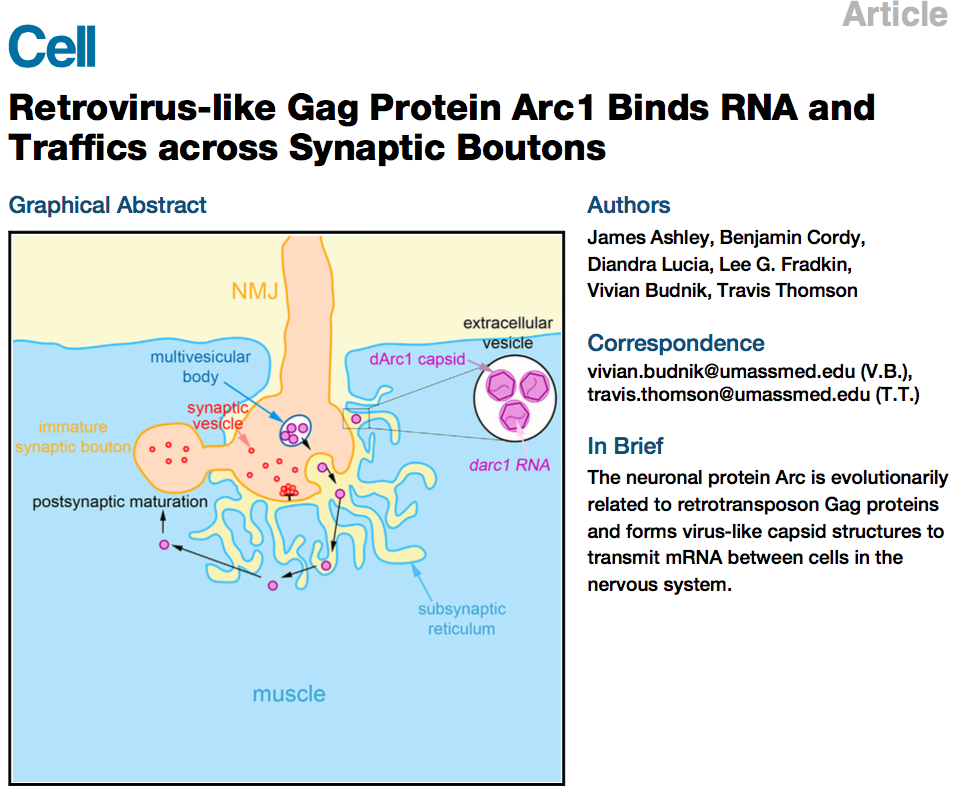
逆转录病毒样Gag蛋白Arc1结合RNA,进行跨突触运输
这两篇文章找到了神经元间转运的新途径:EV。正如Trojan exosomes假说所言,逆转录病毒能把自己的功能分子(比如Gag蛋白)打包进exosomes进行运输,这已经不是什么新鲜事,但没想到哺乳动物中的类Gag蛋白也有这种操作;Arc蛋白本身就对神经系统有着重要作用,无独有偶,现在也越来越多关于EV与神经系统疾病的报道。此外,目前exosomes的重量级研究主要倾向于探索exosomal miRNA(点击回顾2017外泌体重量级文章),而这两篇文章都提出了exosomal mRNA的重要性,它除了能在靶细胞进行蛋白翻译,还对exosomes的转运具有调节作用,这向exosomes研究者们发出了一个信号:外泌体,不止miRNA:其他类型的RNA分子同样具有潜在的功能,有待挖掘。
参考文献:
1. Gould SJ,et al. The Trojan exosome hypothesis. PNAS. 2003 Sep 16;100(19):10592-7.
2. 顾觉奋. 艾滋病疫苗的研究进展: 挑战和曙光[J].中国新药杂志, 2014, 20: 019.
3. BOSELEY S, et al. HIV breakthrough as scientists discover new vaccine to prevent infection[J]. The Guardian, 2009.
4. .Hildreth JEK, et al. HIV As Trojan Exosome: Immunological Paradox Explained? Front Immunol. 2017 Dec 1;8:1715.
5. Aloia, R.C., et al .Lipid composition and fluidity of the human immunodeficiency virus envelope and host cell plasma membranes. Proc Nat AcadSci USA 1993 90: 5181–5185.
6. Wubbolts, R., et al. Proteomic and biochemical analyses of human B cell-derived exosomes.Potential implications for their function and multivesicular body formation. JBiol Chem 2003 278: 10963– 10972.
7. Krishnamoorthy, L., et al. HIV-1 and microvesicles from T cells share a common glycome, arguing for a common origin. Nat Chem Biol 2009 5: 244–250.
8. Théry, C., et al. Exosomes: composition, biogenesis and function. Nat Rev Immunol 2: 569-579
9. Nguyen, D.G., et al. Evidence that HIV budding in primary macrophages occurs through the exosome release pathway. J Biol Chem 2003 278: 52347–52354.
10. Lenassi, M., et al. HIV Nef is secreted in exosomes and triggers apoptosis in bystander CD4+ T cells. Traffic 2010 11: 110–122.
11. Théry, C., et al. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol 2009 9: 581–593.
12. Tardif, M.R., et al. Presence of host ICAM-1 in human immuno deficiency virus type 1 virions increases productive infection of CD4+ T lymphocytes by favoring cytosolic delivery of viral material. J Virol 2003 77:12299–12309.
13. Izquierdo-Useros, N., et al. Maturation of blood-derived dendritic cells enhances human immunodeficiency virus type 1 capture and transmission. J Virol 2007 81: 7559–7570.
14. Ramakrishnaiah V, et al. Exosome-mediated transmission of hepatitis C virus between human hepatoma Huh7.5 cells[J]. Proc Natl Acad Sci USA, 2013,110(32):13109-13113.
15. Columba Cabezas S, et al. Sequences within RNA coding for HIV-1 Gag p17 are efficiently targeted to exosomes.Cell Microbiol. 2013 Mar;15(3):412-29.
16 Meckes D G Jr, et al. Human tumor virus utilizes exosomes for intercellular communication[J]. Proc Natl Acad Sci USA, 2010,107(47):20370-20375.
17. Pastuzyn E D, et al. The Neuronal Gene Arc Encodesa Repurposed Retrotransposon Gag Protein that Mediates Intercellular RNA Transfer. Cell 2008, 172, 275–288.
18. Ashley J, et al., Retrovirus-like Gag Protein Arc1 Binds RNA and Traffics across Synaptic Boutons . Cell 2018, 172, 262–274.
推荐阅读
● 专享优惠| 2018外泌体与疾病研讨会报名85折!外泌体测序还可免费参会!
● NSFC| 你所关心的国自然中标项目分析: 外泌体.非编码RNA.增强子...
- - - 推荐阅读 - - -
年度回顾| 2017外泌体重量级研究一览,看这篇就够了
刚过去的2017年,也是外泌体研究热度持续升温的一年,在多个领域均涌现了重大的研究进展。今天,我们一起来回顾2017“外泌体年”吧!
2018-01-16
Mol Cell: 超级增强子突变促黑色素瘤生长
BET的抑制剂BETi目前是很有前景的转移性黑色素瘤治疗药物,但作用机制尚不明确。最近,来自纽约大学郎格尼医学中心的研究者于Molecular Cell 发表了一篇文章,解答了这个问题。
2017-12-19
振奋人心的3D基因组技术:GRID-seq探索RNA-DNA相互作用
突破性进展!UCSD付向东团队开发新技术,首次实现全基因组范围RNA-DNA相互作用的全谱鉴定!
2017-12-01
