客户文章 | Adv Sci:聂广军/赵颖/杨尹默团队揭示超级增强子在胰腺导管癌药物治疗中起重要作用
2024年4月24日,国家纳米科学技术中心/中科院纳米科学卓越创新中心/纳米生物效应与安全性重点实验室聂广军/赵颖团队、北京大学第一医院普外科杨尹默团队在ADVANCED SCIENCE发表题为“Disruption of Super-Enhancer in Activated Pancreatic Stellate Cells Facilitates Chemotherapy and Immunotherapy in Pancreatic Cancer”的研究论文,揭示了超级增强子(SEs)促进与胰腺星状细胞激活相关的各种基因的表达。用JQ1(BET 溴结构域抑制剂)干扰与SEs相关的转录,可逆转激活的胰腺星状细胞(a-PSCs)的激活表型,并减少原位和人源性组织异种移植(PDX)模型中的基质纤维化。靶向a-PSCs中SEs,通过消除基质屏障有利于胰腺导管癌(PDAC)的药物治疗。

文章索引
【题目】Disruption of Super-Enhancers in Activated Pancreatic Stellate Cells Facilitates Chemotherapy and Immunotherapy in Pancreatic Cancer
【期刊】ADVANCED SCIENCE
【发表时间】2024年4月24日
【IF】15.1(一区)
【单位/作者/团队】国家纳米科学技术中心/中科院纳米科学卓越创新中心/纳米生物效应与安全性重点实验室聂广军/赵颖团队、北京大学第一医院普外科杨尹默团队
研究结果
1. SEs对人a-PSCs的激活起重要作用
研究者通过免疫组化实验、TCGA数据库以及GSA数据库分析,确定a-PSCs(胰腺星状细胞)为PDAC(胰腺导管腺癌)组织的重要组分,它高表达的胶原相关基因(如COL1A1和COL1A2)与患者的无病生存期(DFS)显著缩短有关。为确定a-PSCs中的SEs景观,使用H3K27ac ChIP-seq和ATAC-seq联合分析(技术服务由表观生物提供),确定a-PSCs中SEs可潜在调控1121个基因,对其中几个代表性基因进行GO分析,结果显示这些基因主要富集与ECM组织相关的生物过程中,表明SEs可能有利于PSCs的激活。为进一步验证,进行了a-PSCs的ATAC-seq,结果发现ChIP-seq和ATAC-seq获得的SE图谱基本一致,证实ChIP-seq的可靠性。
对JQ1治疗后并分离的原代人a-PSCs进行H3K27ac ChIP-seq和ATAC-seq,结果发现未改变SEs景观和染色质开放性,但显著抑制ECM相关基因的表达。使用CRISPR/Cas9技术进一步证实SEs在基因激活中的作用。
对JQ1治疗和未治疗的a-PSCs分别进行ChIP-qPCR检测,结果表明JQ1治疗的a-PSCs通过减少BRD4在SE区域的占据显著抑制FAP-α和IL6的表达。
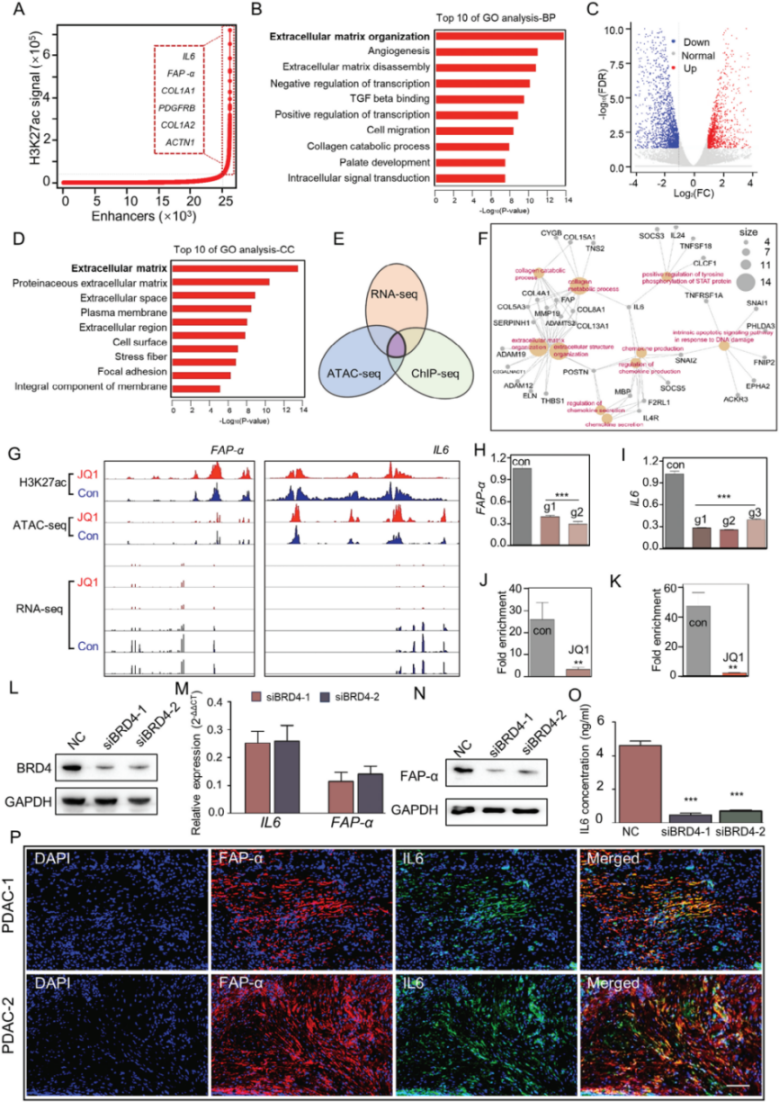
图1. 超级增强子与参与a-PSCs激活的基因有关
以下技术服务由表观生物提供

图2. A.H3K27Ac ChIP-seq数据绘制a-PSCs的SEs区域;B)GO富集分析条形图;C)对照组和JQ1组差异表达基因火山图
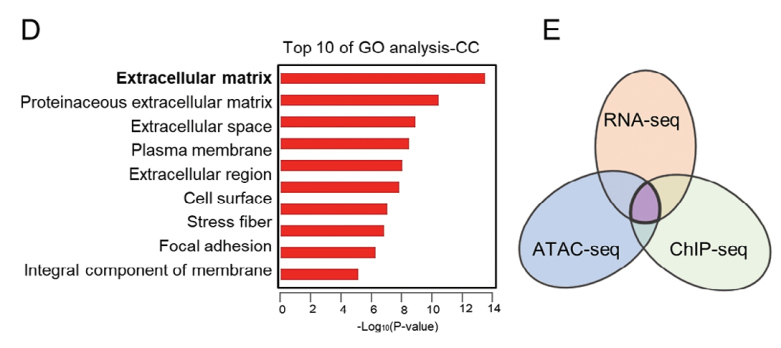
图3. D)GO富集分析条形图;E)韦恩图
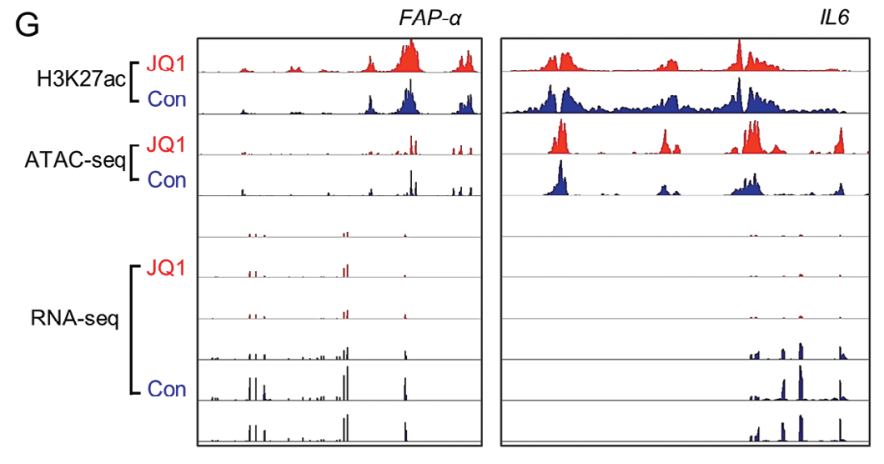
图4G. JQ1组和对照组的H3K27ac ChIP-seq、ATAC-seq和RNA-seq数据图谱
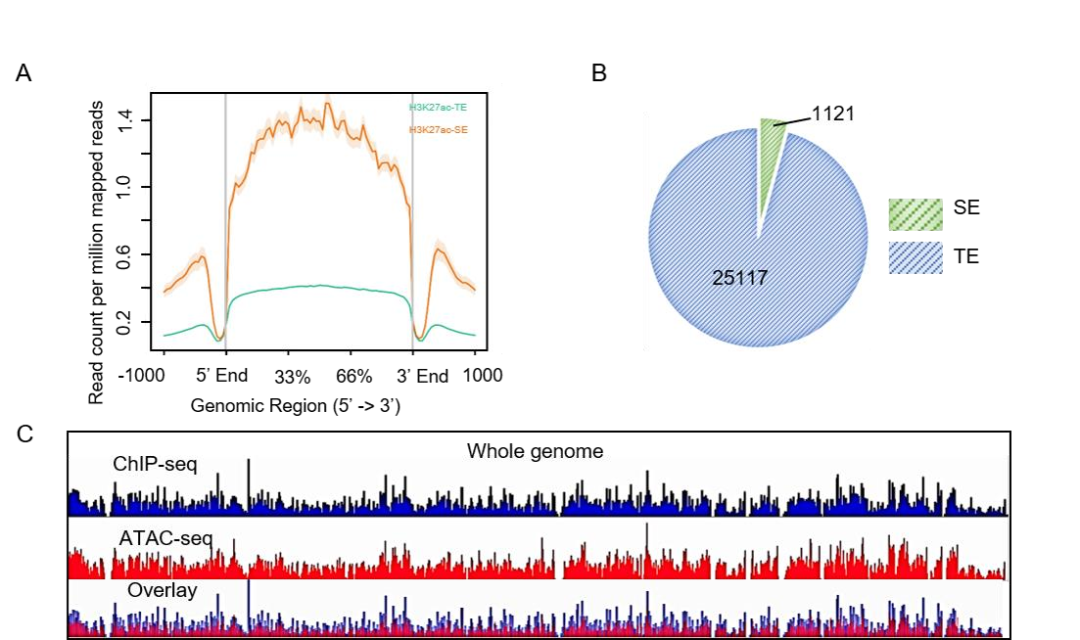
图5. A)a-PSCs中TE和SE的信号丰度图;B)SE和TE饼图;C)IGV可视化的a-PSCs全基因组H3K27ac ChIP-seq和ATAC-seq图谱(文章支撑材料)
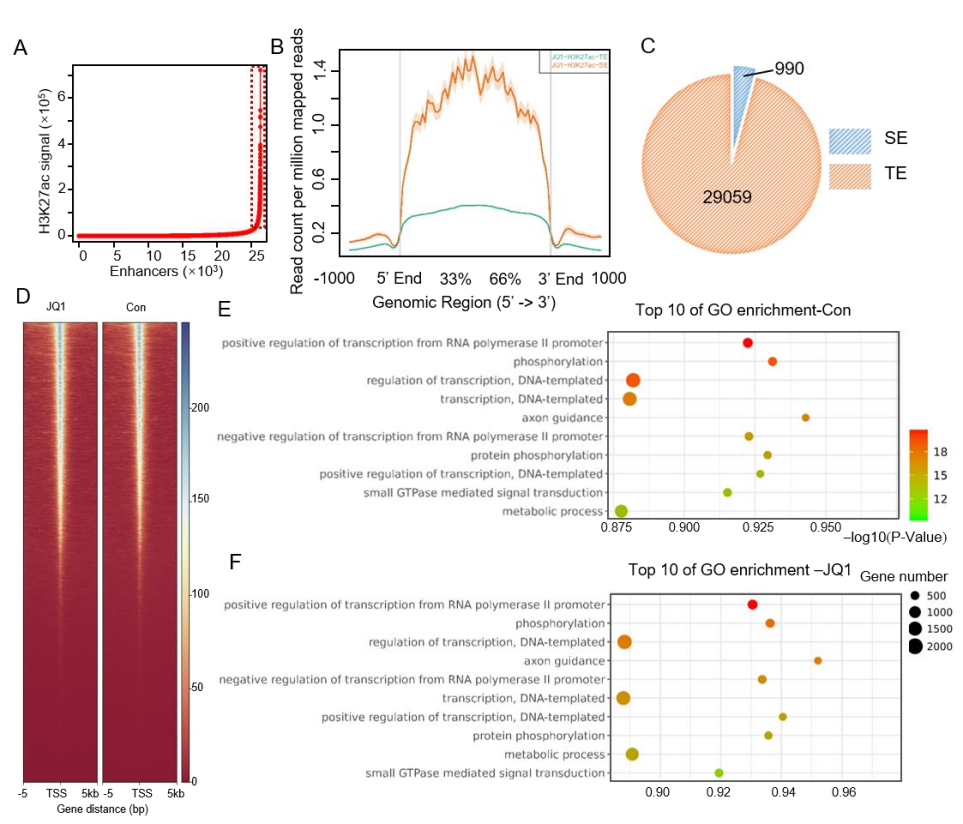
图6. A)H3K27Ac ChIP-seq数据绘制JQ1处理的a-PSCs的SEs区域;B)JQ1处理的a-PSCs中TE和SE的信号丰度图;C)SE和TE饼图;D)ATAC-Seq得出的对照组和JQ1组的分布热图;E)对照组和JQ1组GO富集分析气泡图(文章支撑材料)
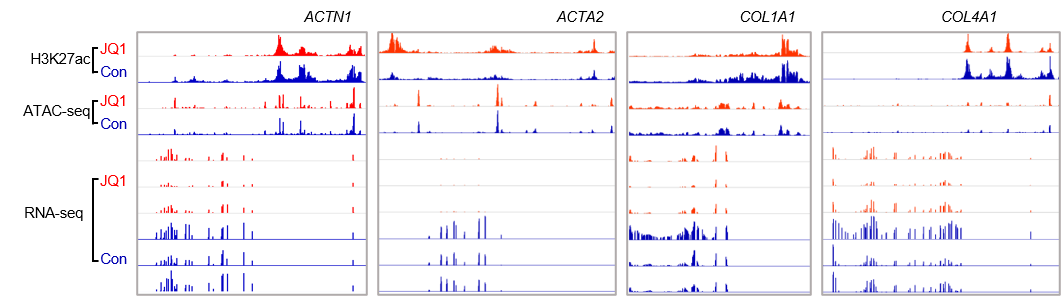
图7. 基因ACTN1, ACTA2, COL1A1 and COL4A1的H3K27ac ChIP-seq、ATAC-seq和RNA-seq数据图谱(文章支撑材料)
2. JQ1治疗在体内和体外逆转了原代人a-PSCs的激活表型
通过IF发现JQ1治疗后显著降低了a-PSCs标记蛋白FAP-α、α-SMA和Ⅰ型胶原的表达水平,并改变了细胞形态。通过模拟PDAC肿瘤微环境的体外3D细胞培养模型研究和qRT-PCR,结果显示降低了相关基因的表达水平。
在原位胰腺癌模型中,JQ1对肿瘤生长没有显著抑制,但显著降低了肿瘤组织中相关标记蛋白水平及胶原沉积,在PDX中观察到相似结果。
综上,JQ1通过抑制SEs介导的基因过表达,有效逆转了a-PSCs的激活表型,并缓解了PDAC肿瘤的纤维化。
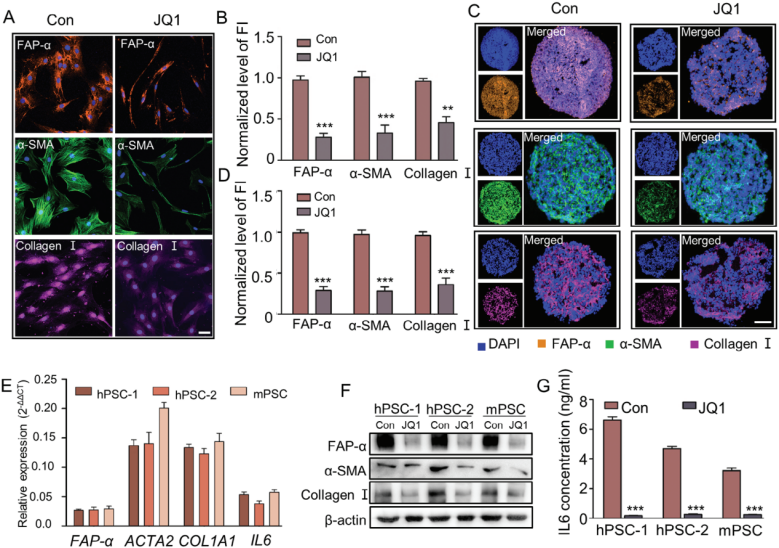
图8. 破坏SEs降低了a-PSCs激活相关基因的mRNA和蛋白水平的表达
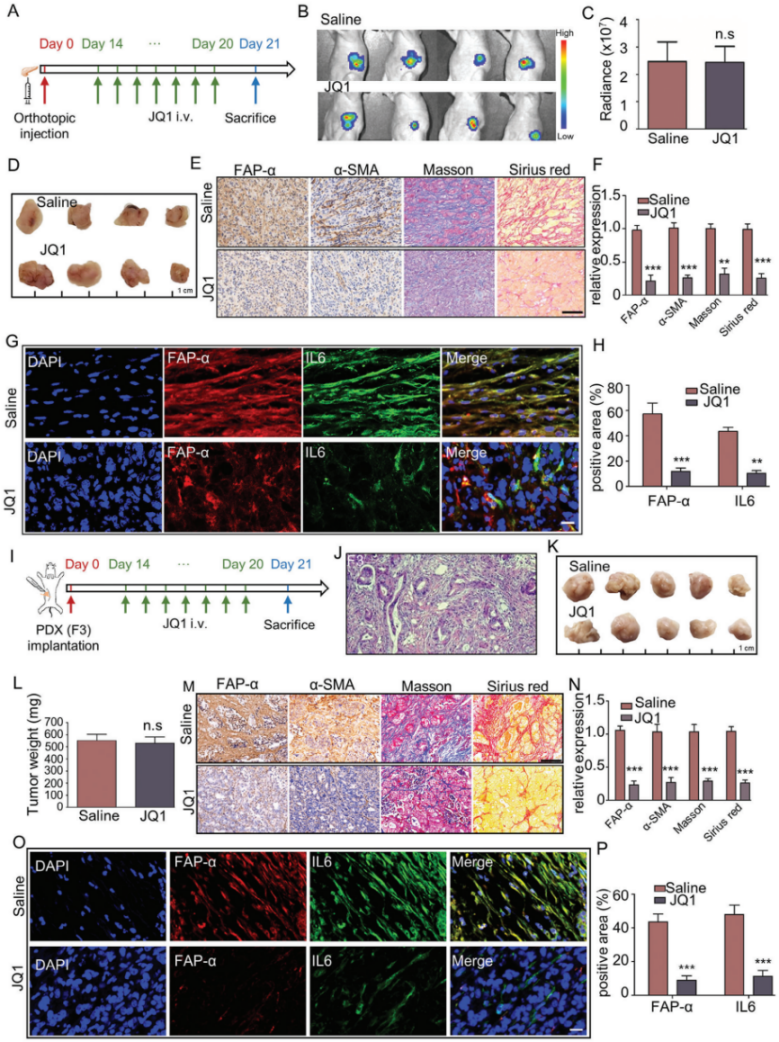
图9. JQ1治疗破坏SEs后减轻体内PDAC组织的间质纤维化
3. JQ1治疗增强PDAC肿瘤的药物渗透和血管化
体外实验结果显示,在人和小鼠3D模型中,显著增加了FITC-BSA在JQ1治疗后肿瘤球中的渗透深度。
体内实验结果显示,JQ1治疗增强了原位肿瘤组织中的Cy7信号强度和荧光球的渗透,表明JQ1治疗提高了PDAC组织中的药物渗透。
通过原位模型发现,JQ1治疗增加了肿瘤内血管密度。多光子荧光显微镜和AngioTool分析结果表明,JQ1治疗组肿瘤内血管密度显著高于生理盐水组。IF检测CD31阳性,JQ1治疗显著增加了PDAC肿瘤的血管化,PDX模型中也得到了类似结果。
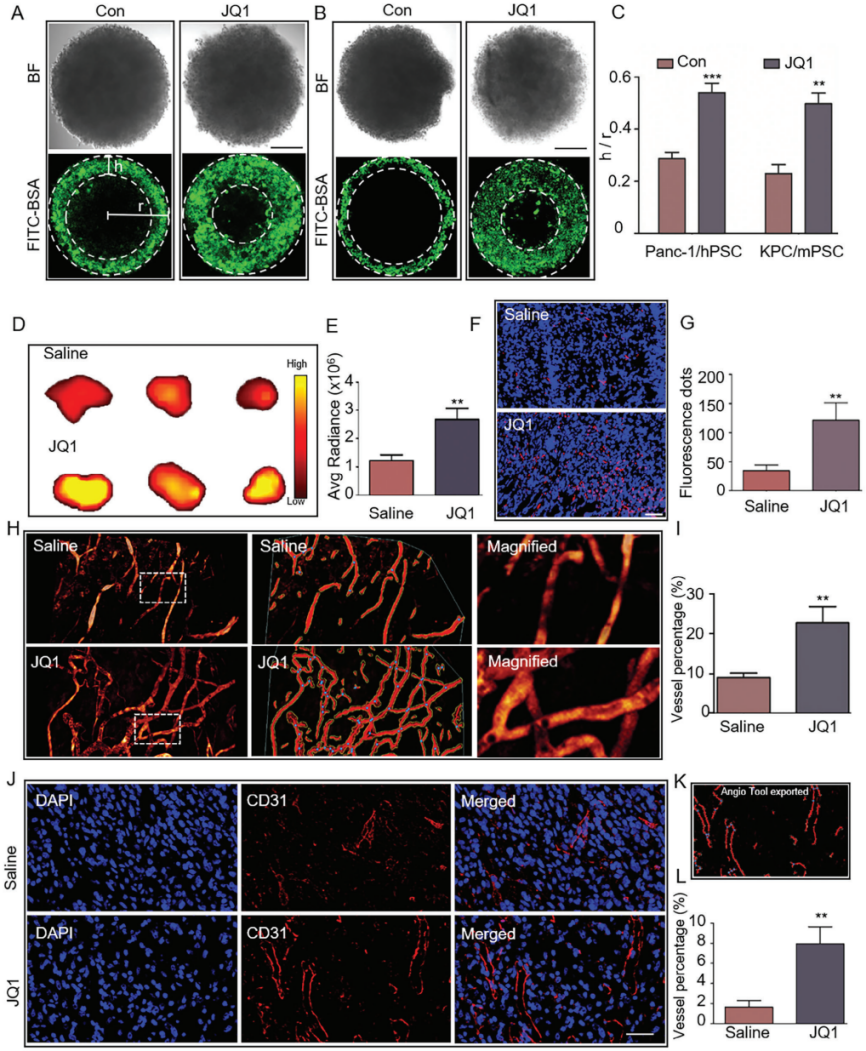
图10. JQ1治疗对SEs的破坏增强了PDAC肿瘤的药物渗透并促进了血管化
4. JQ1治疗增强吉西他滨(Gemcitabine,GEM)抗体内PDAC的抗肿瘤效力
原位胰腺癌模型的研究结果显示,JQ1+GEM治疗显著降低了肿瘤的荧光强度,并减少了肿瘤体积和重量。IHC和TUNEL检测表明JQ1处理增强了GEM的抑制增殖和促进凋亡的作用。在PDX胰腺癌模型中也得到类似结果。
综上,JQ1通过增强药物渗透和血管化,提高了GEM对PDAC的抗肿瘤效力。
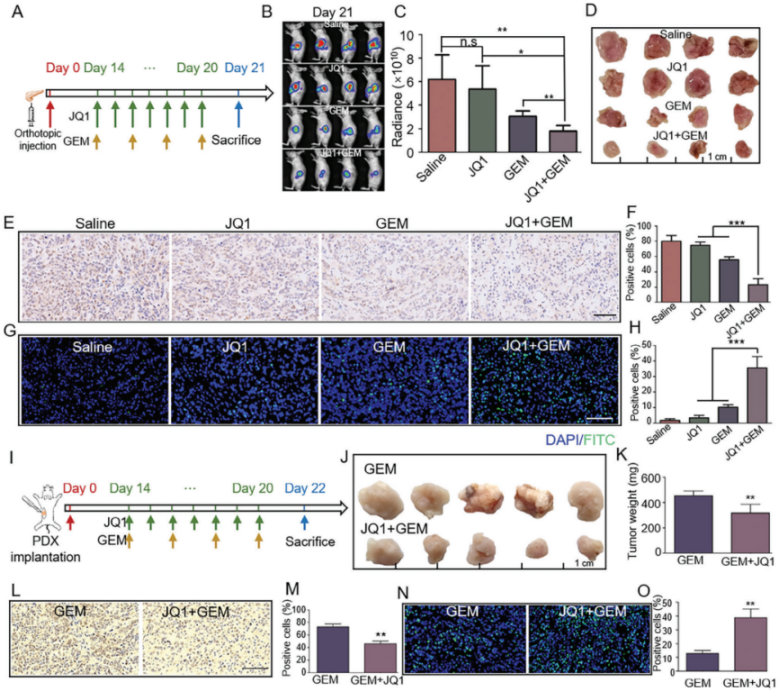
图11. JQ1治疗增强GEM抗体内PDAC的抗肿瘤效力
5.JQ1治疗增强免疫活性原位胰腺癌小鼠模型肿瘤组织中 CD8+T细胞浸润
通过IHC检测验证了在PDAC组织中,CD8+T细胞的浸润与基质丰富度呈负相关这一结论,并利用单细胞测序数据进一步确认了这一负相关关系。
对原位胰腺癌小鼠模型的研究结果显示,JQ1治疗不仅显著降低了肿瘤重量和荧光信号强度,还减少FAP-α、α-SMA蛋白水平以及胶原沉积。IF检测结果显示,JQ1治疗显著增加了CD8+T细胞的浸润。
综上,表明JQ1处理可以通过逆转a-PSCs的活化,增强CD8+T细胞在PDAC组织中的浸润,支持其在免疫治疗中的潜在应用。
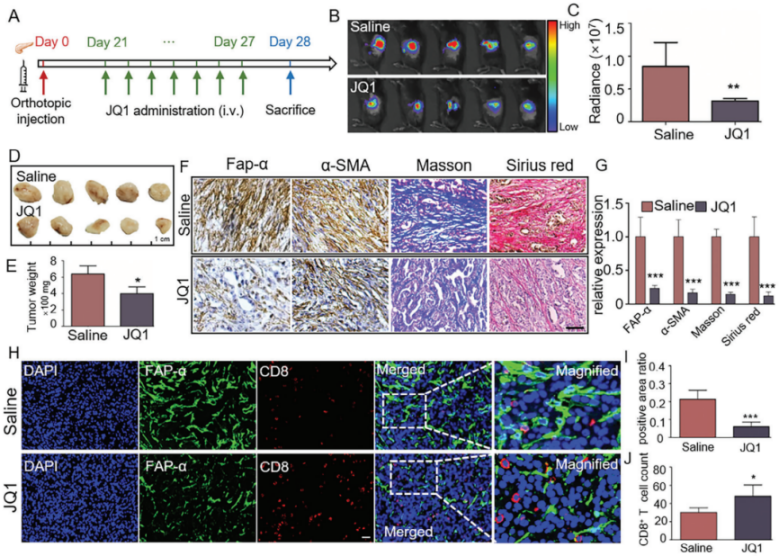
图12. JQ1治疗可增强PDAC肿瘤组织中CD8+T细胞的浸润
6. JQ1治疗可增强IL12免疫疗法抗对体内PDAC的抗肿瘤效力
在原位胰腺癌小鼠模型中使用JQ1和低剂量IL12的组合,发现该组合显著抑制了肿瘤生长,增加了CD8+ T细胞和自然杀伤细胞的浸润,减少了调节性T细胞(Treg细胞)。
JQ1通过改变肿瘤微环境,增强了IL12的疗效,提高了其抗PDAC的效果。
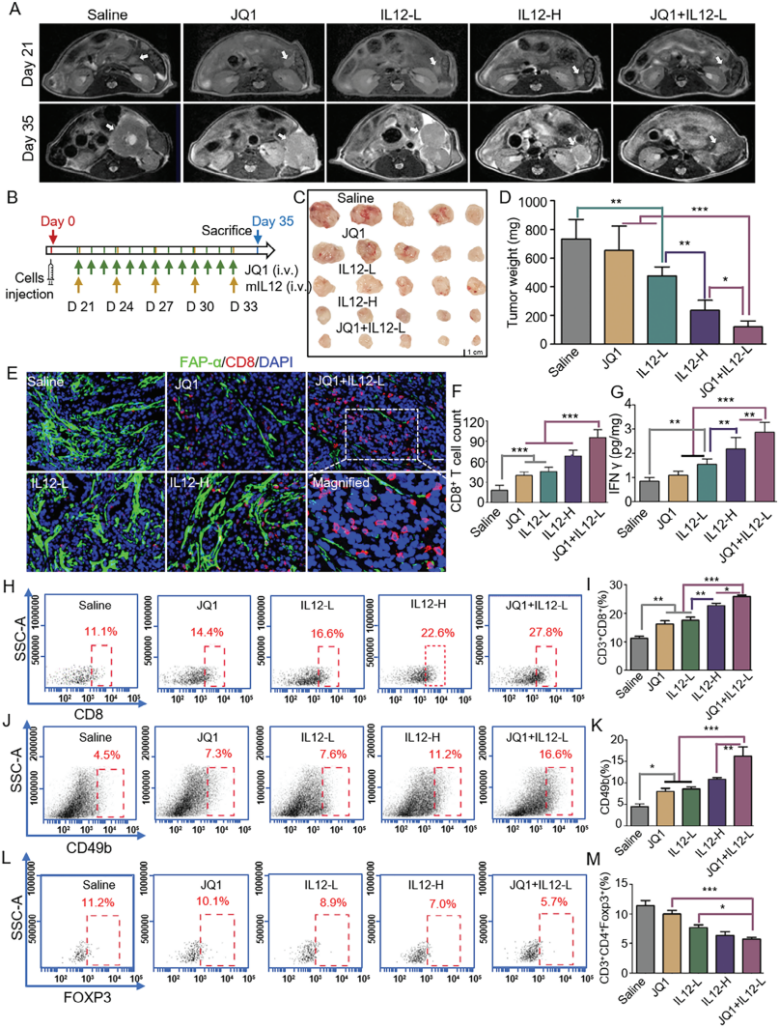
图13. JQ1治疗可增强IL12免疫疗法抗对体内PDAC的抗肿瘤效力
讨论
这篇文章探讨了在PDAC中,破坏a-PSCs的SEs对化疗和免疫治疗的促进作用。研究显示,a-PSCs在PDAC的纤维化微环境中起关键作用,SEs驱动了多种基因的表达,这些基因参与了a-PSCs的激活。通过抑制SEs相关的转录,可以逆转a-PSCs的激活状态,从而减少肿瘤的纤维化并改善药物递送和免疫环境,最终提高化疗和免疫治疗的效果,为PDAC患者提供潜在的治疗新途径。
参考文献:
[1] Wang Y, Chen K, Liu G, et al. Disruption of Super-Enhancers in Activated Pancreatic Stellate Cells Facilitates Chemotherapy and Immunotherapy in Pancreatic Cancer. Adv Sci (Weinh). 2024;11(16):e2308637.

欢迎拨打400-775-0875或
识别二维码咨询微信客服
- - - 推荐阅读 - - -

技术讲座直播季开启!首场解码空间转录组学:技术、分析及应用,5月8日晚圆满结束
空间转录组测序的核心是含空间坐标信息的DNA编码捕获热点[1],弥补了单细胞测序丢失空间位置信息的缺陷,还原组织原貌,为生命科学和疾病研究带来更深刻的见解,因而被Nature Methods评为2020年度技术。
2024-05-11
客户文章| Circ Res:南京医科大学孔祥清团队揭示NAT10介导ac4C乙酰化修饰在心脏重构中的新机制
表观生物为此提供acRIP-seq、RNA-seq、SLAM-seq技术服务
2023-11-24

大咖云集!2023表观遗传前沿理论与方法学术论坛,免费注册啦!
增强子与染色质高级结构;表观遗传修饰与转录调控;非编码RNA与疾病标志物;单细胞多组学,四大精彩主题!
2023-10-18
