客户文章| Circ Res:南京医科大学孔祥清团队揭示NAT10介导ac4C乙酰化修饰在心脏重构中的新机制

首先,该团队史倞(Jing Shi)、杨传熙(Chuanxi Yang)、张晶(Jing Zhang)、赵锟(Kun Zhao)博士等通过分析三个公开发表的扩张性心肌病患者左心室样本的单细胞测序数据,发现相较于对照样本,人扩张性心肌病中NAT10表达显著升高,并且NAT10表达升高集中在心肌细胞及活化的心脏成纤维细胞中。进一步,通过在多种体外和体内心脏重构模型以及心肌肥厚患者中检测发现,NAT10及ac4C乙酰化修饰水平均显著升高,提示心脏重构中NAT10介导的ac4C乙酰化修饰可能是一种普遍且相对保守的分子机制。
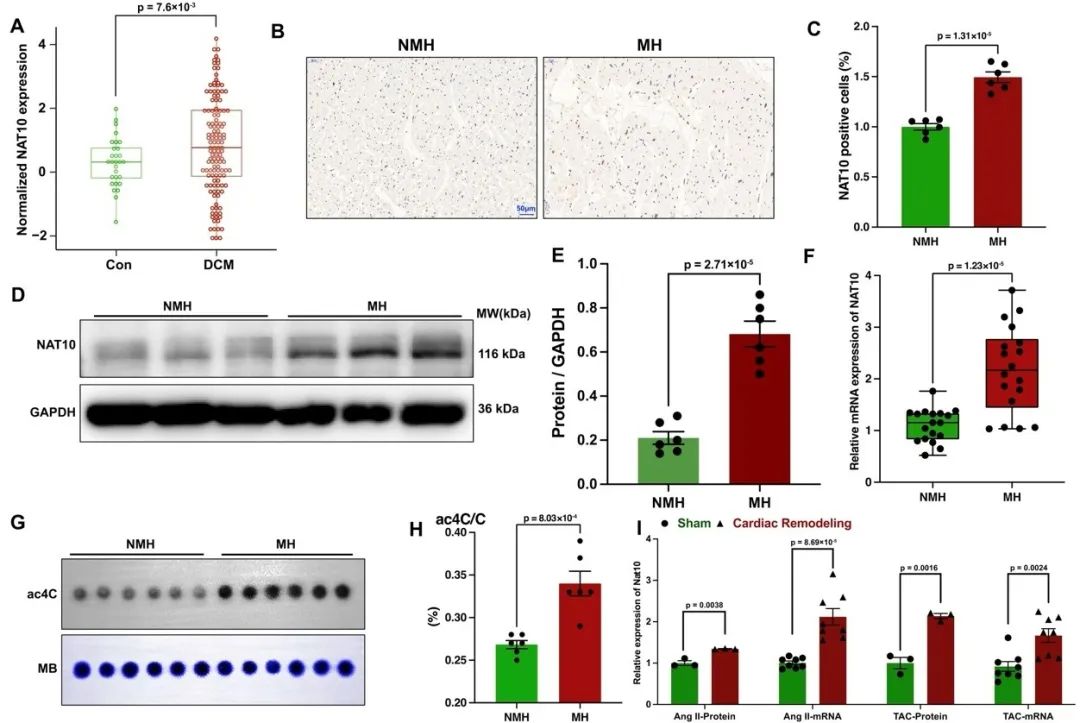
图1
接着,为了探究NAT10在心脏重构中的功能,研究者设计了一系列体外(心肌细胞(neonatal mouse cardiomyocytes, NMCMs)、心肌成纤维细胞(neonatal mouse cardiac fibroblasts, NMCFs))和体内(Ang Ⅱ、TAC模型)功能获得和功能缺失实验。充分证实了沉默或抑制NAT10表达,可显著改善心脏重构模型中结构和心功能改变,包括心肌细胞肥大、纤维化、心脏重构基因表达和炎症因子释放过程。
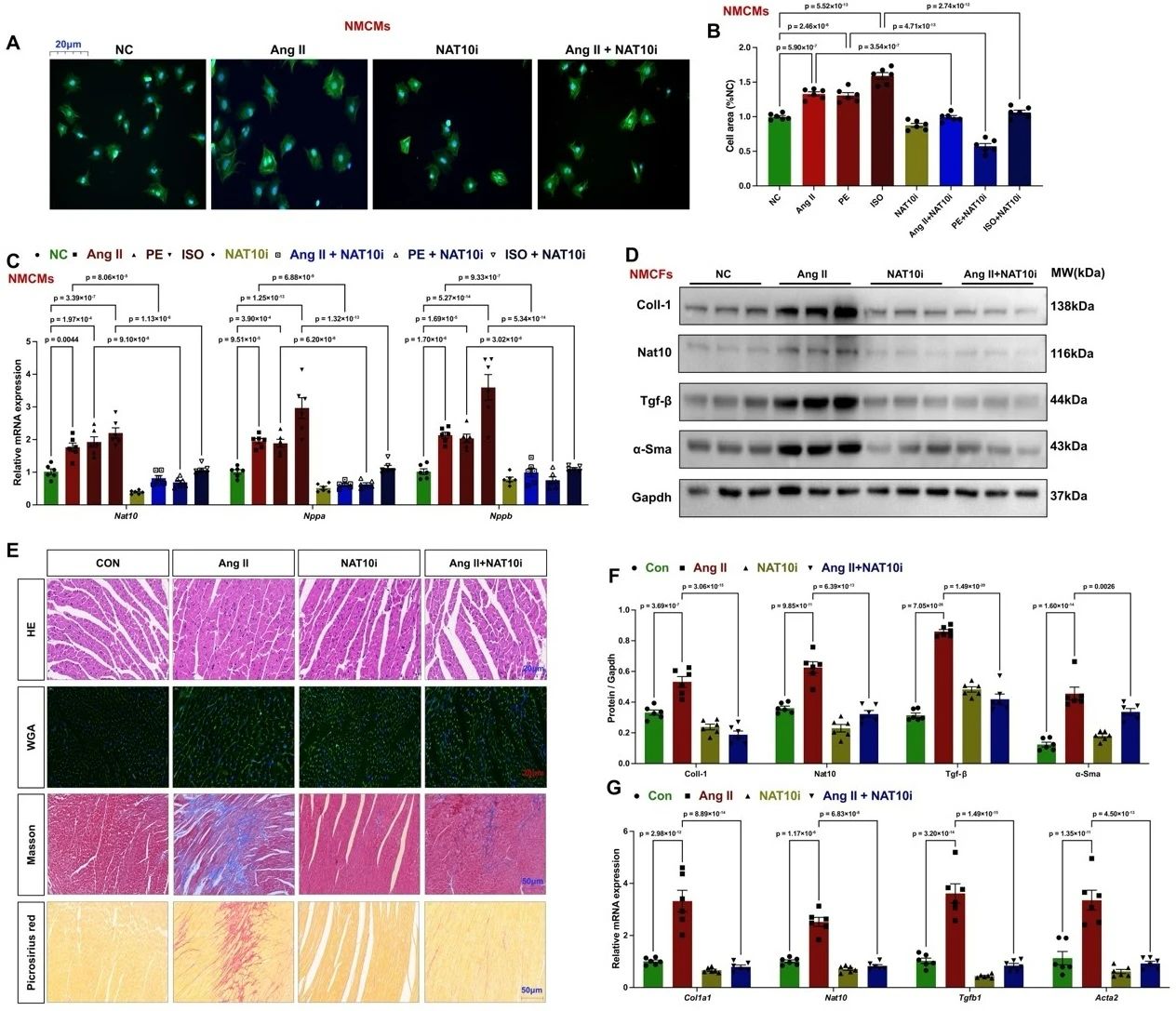
图2
前人研究显示,NAT10是现已知RNA ac4C乙酰化修饰唯一调控酶。因此,研究者利用ac4C-RIP-seq技术首次全面系统的揭示了人心肌肥厚组织及小鼠心脏重构模型中的ac4C乙酰化修饰图谱。通过功能富集分析发现两个物种之间存在显著的重叠,其ac4C乙酰化修饰的转录本主要编码与超分子纤维组织、肌动蛋白丝基础过程和肌肉系统过程相关的蛋白质,并进一步证实了ac4C乙酰化修饰可能通过改变某些关键基因的表达,从而参与心脏重构过程。

图3. 其中acRIP-seq技术服务由表观生物提供
鉴于已知NAT10介导ac4C在转录后水平上可调控mRNA稳定性和翻译效率。研究者首先通过SLAM-seq技术在过表达NAT10的NMCMs及NMCFs中检测mRNA稳定性,结果证实,上调NAT10后,NMCMs及NMCFs中mRNA稳定性均明显提高。通过多组学联合分析及功能富集分析进一步聚焦共同的ECM-receptor interaction信号通路,其中包括已有报道在心脏重构中发挥重要作用的关键基因Cd47、Rock2、Itga9、Fn1、Sptbn1和Hspg2。进一步通过实验筛选发现,在心脏重构中,NAT10高表达可能是通过增加Cd47和Rock2 mRNA的ac4C水平稳定其表达,从而参与促进心脏重构的潜在原因。
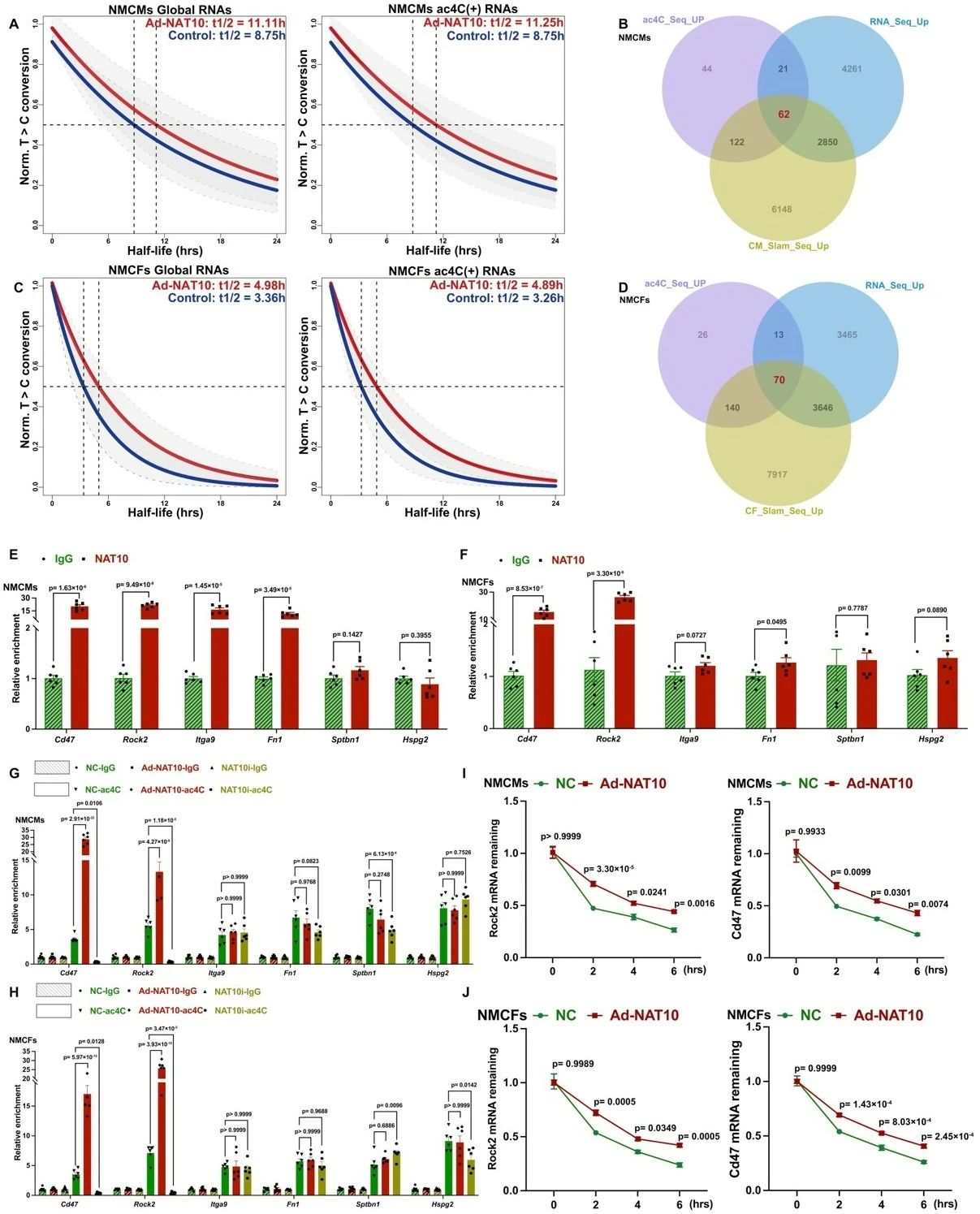
图4. 其中acRIP-seq、RNA-seq、SLAM-seq技术服务由表观生物提供
进一步,研究者利用Ribo-seq技术继续探索NAT10介导ac4C乙酰化修饰在心脏重构中调控mRNA翻译效率研究。结果证实,心脏重构小鼠中富集于心脏相关生物过程的转录本的翻译效率发生了改变,NAT10介导ac4C乙酰化修饰可显著提高关键基因的翻译效率。有意思的是,通过多组学联合分析发现可能存在7个关键基因(Cd47、Rock2、Fn1、Cox4、C3、Zfp3、Rn7sk)可能参与了心脏重构过程,而上述验证实验明确了只有Cd47和Rock2在NMCMs和NMCFs中可被NAT10调控其ac4C乙酰化修饰水平。这些数据表明,CD47和ROCK2可能是心脏重构过程中NAT10的重要靶点。
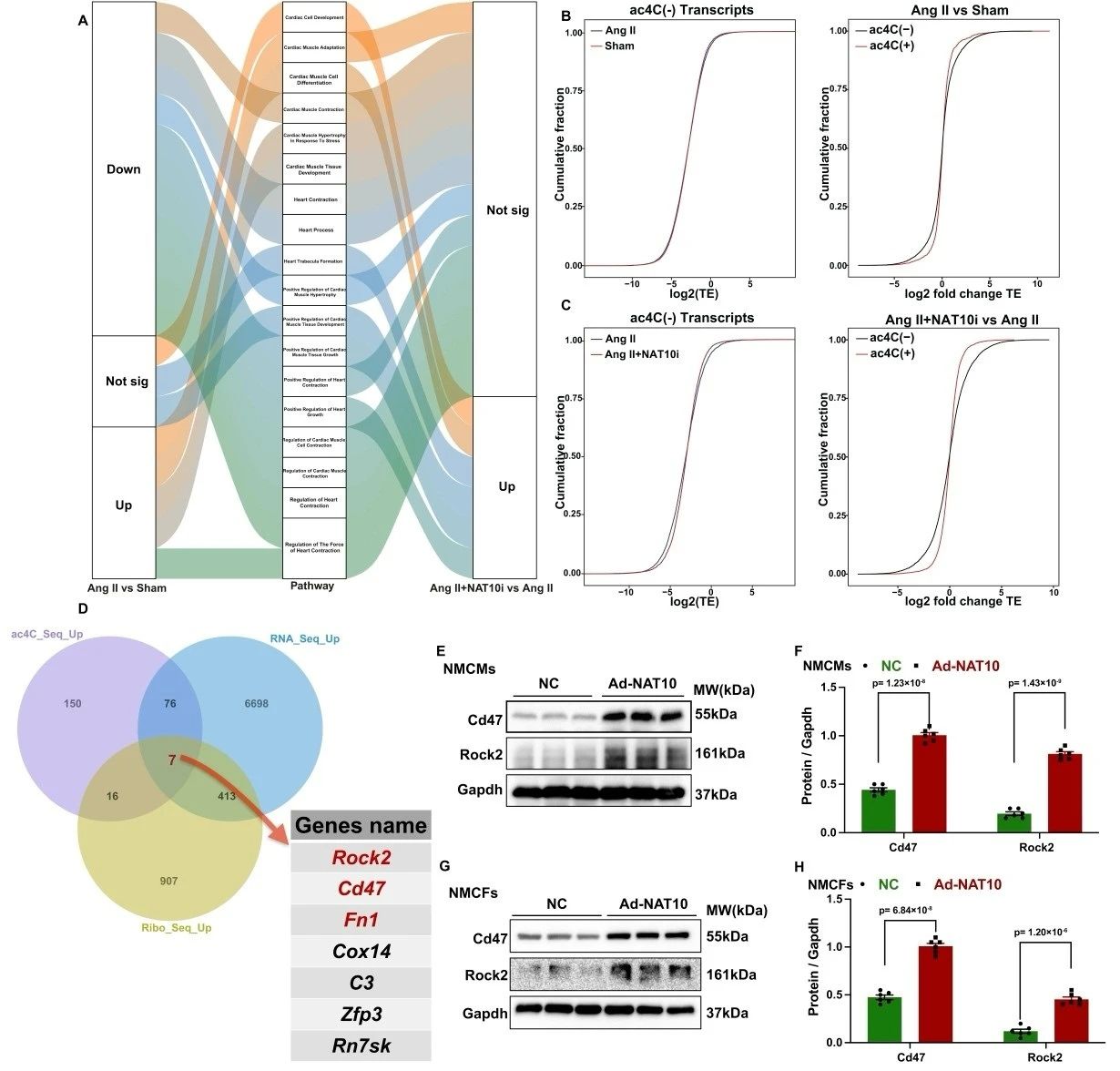
图5
最后,研究者利用已知的NAT10抑制剂Remodelin,通过TAC心脏重构模型进一步证实,无论是在TAC诱导之前还是之后给药,Remodelin均能显著改善心功能障碍、心肌细胞肥大、纤维化和炎症反应。
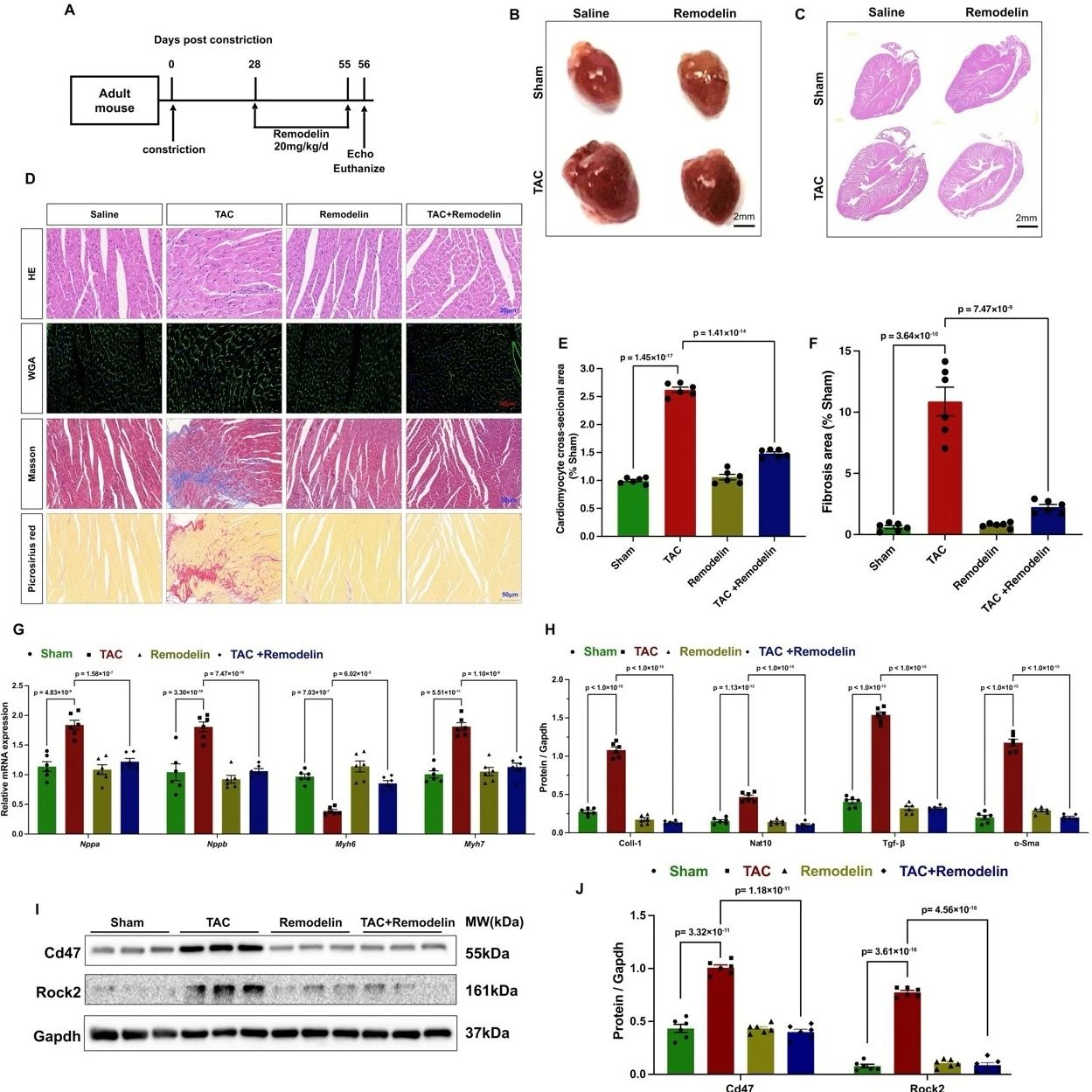
图6
综上所述,本研究首次在人类和小鼠心脏重构样本中发现了NAT10及ac4C乙酰化修饰水平升高的普遍规律,首次系统的揭示了心脏重构中ac4C乙酰化修饰图谱,并揭示了NAT10介导ac4C乙酰化修饰作为一种调节心力衰竭中心脏重构新机制,同时探索了NAT10介导ac4C乙酰化修饰调控CD47和ROCK2的下游调控机制,为临床上治疗心力衰竭中心脏重构提供了潜在的治疗新靶点。
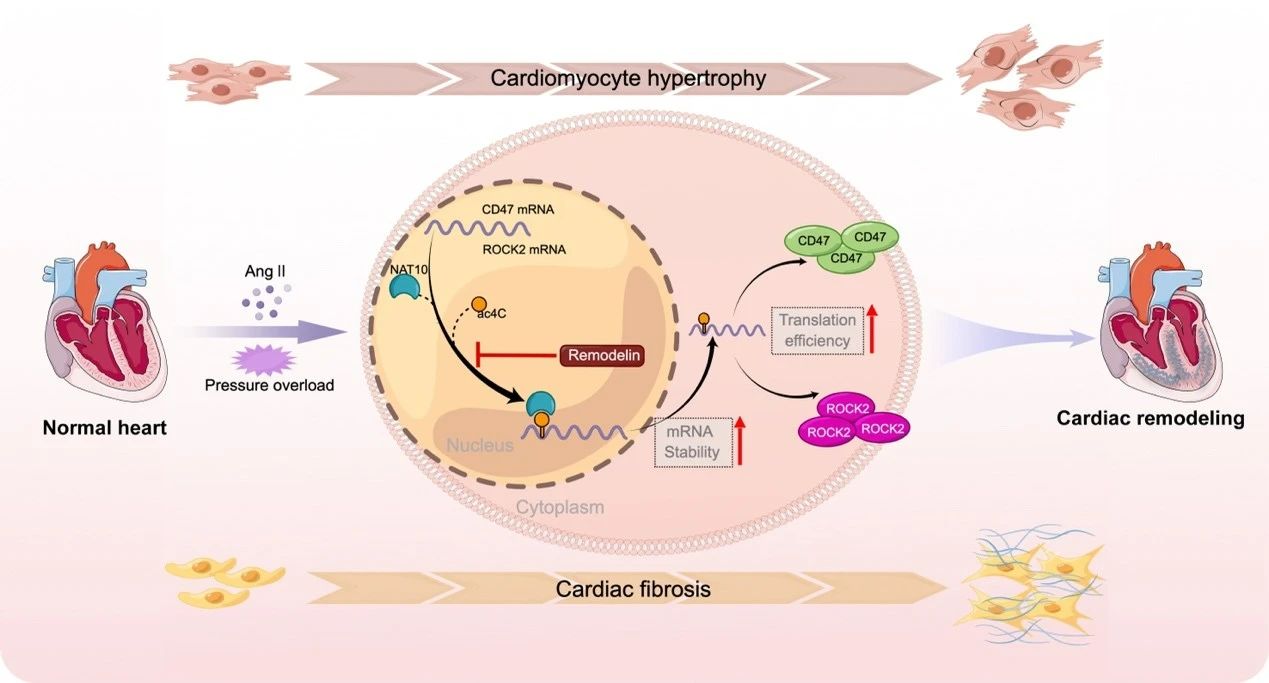
图7



