客户文章 | m6A去甲基酶FTO通过自噬抑制口腔鳞癌发展

期刊:Oncogene
IF:7.971
摘 要
m6A是真核生物中最丰富的内源性mRNA修饰,在肿瘤发生中起着重要作用,然而,其内在机制仍不十分清楚。来自中山大学口腔医院的研究团队在今年5月份在线发表了m6A修饰与口腔鳞状细胞癌(OSCC)相关研究成果[1]。研究者建立了雷帕霉素(rapamycin)诱导自噬的细胞模型来筛选m6A修饰酶,发现m6A去甲基化酶FTO通过靶向编码eIF4G1(真核细胞翻译起始因子γ1)的基因,在OSCC的自噬和肿瘤发生中起关键作用。敲除OSCC细胞系中FTO的表达,会导致eIF4G1的下调,同时增强自噬潮(或称自噬通量)和抑制肿瘤发生。雷帕霉素还会抑制FTO活性,直接靶向eIF4G1转录本,以m6A依赖方式介导其表达。双荧光素酶报告和突变实验证实,YTHDF2靶向eIF4G1。最后,在FTO沉默后,YTHDF2捕获含有m6A的eIF4G1转录本,导致mRNA降解和eIF4G1蛋白表达水平下降,从而促进自噬、减少肿瘤发生。因此,雷帕霉素可能通过调节m6A水平,决定OSCC的自噬潮,从而影响癌细胞的生物学特性。这一发现拓宽了我们对肿瘤发生过程中自噬和RNA甲基化之间的相互作用的理解,对于OSCC治疗策略的制定至关重要。
关键研究技术
meRIP-seq、m6A修饰定量、基因半衰期检测等
研究思路
这篇文章的主要研究思路整理如下图:
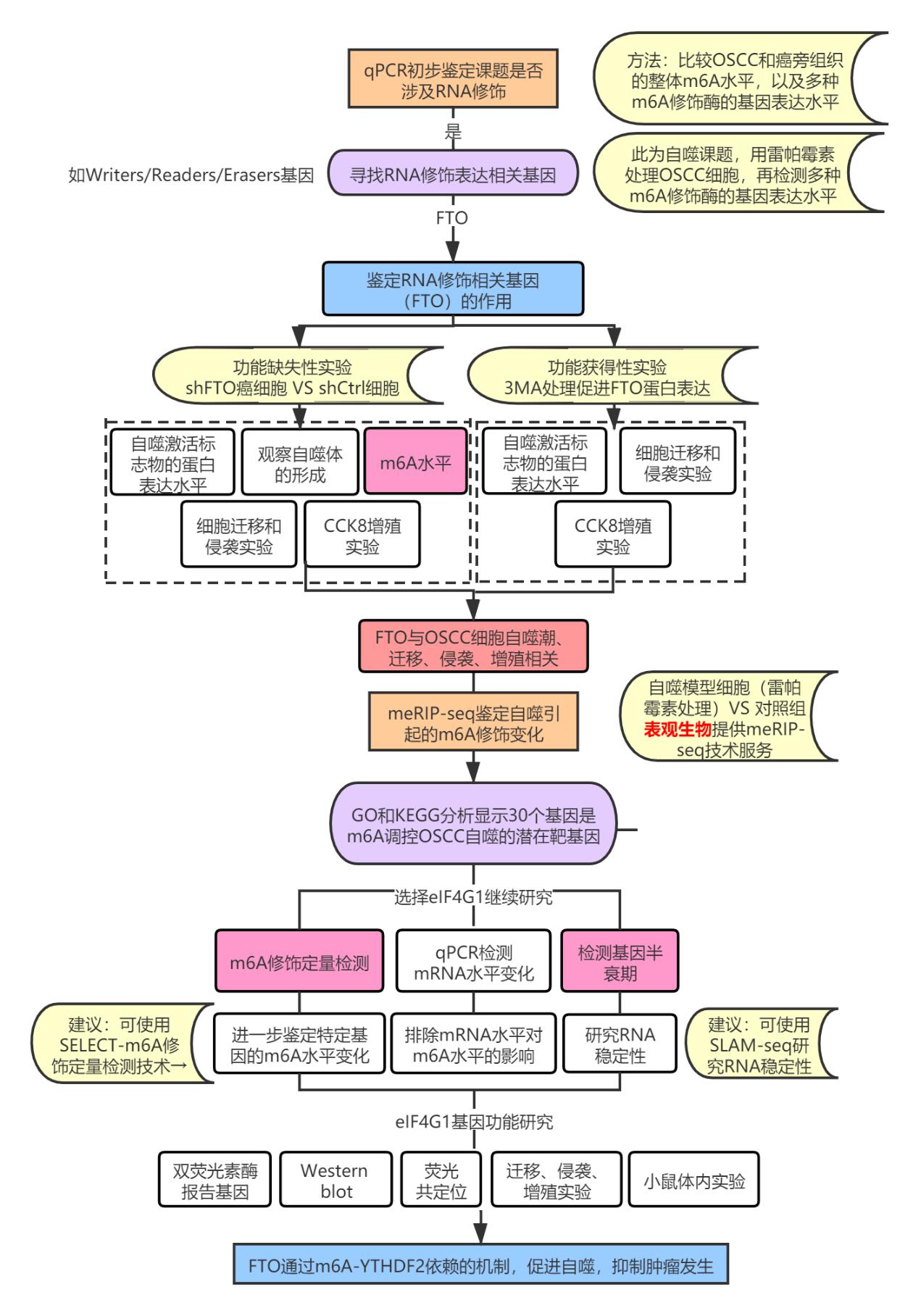
图1. 本研究整体研究思路
初筛
在研究伊始,OSCC发生发展是否涉及RNA修饰仍是一个问号,于是研究者首先对这个问题做了一个初步的鉴定:
1.比较OSCC和癌旁组织的整体m6A水平;
2.检测多种m6A修饰相关的蛋白的表达水平,包括METTL3、METTL14、WTAP、FTO和ALKBH5。
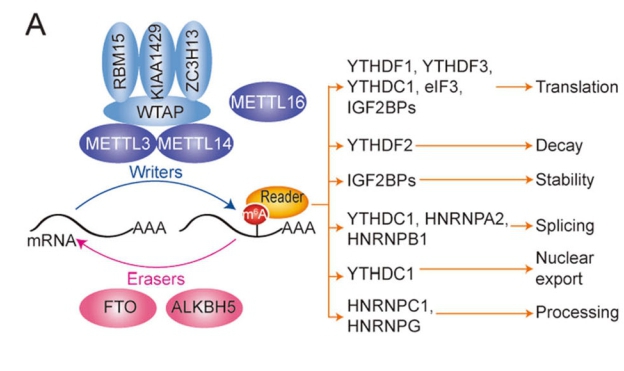
小知识
研究者通过实验发现在自噬细胞模型中,FTO表达水平的减少最显著,于是以FTO为研究对象,通过沉默FTO以及自噬抑制剂处理,一系列实验验证(详见研究路线图),证明FTO对OSCC细胞的作用。
meRIP-seq挖掘靶基因
研究至此,meRIP-seq登场了:通过对雷帕霉素诱导的自噬OSCC细胞进行meRIP-seq及生信分析,GO和KEGG的分析结果显示涉及自噬相关的基因(图2d),研究者取了自噬相关基因和m6A调控基因的交集,有30个(图2e)。
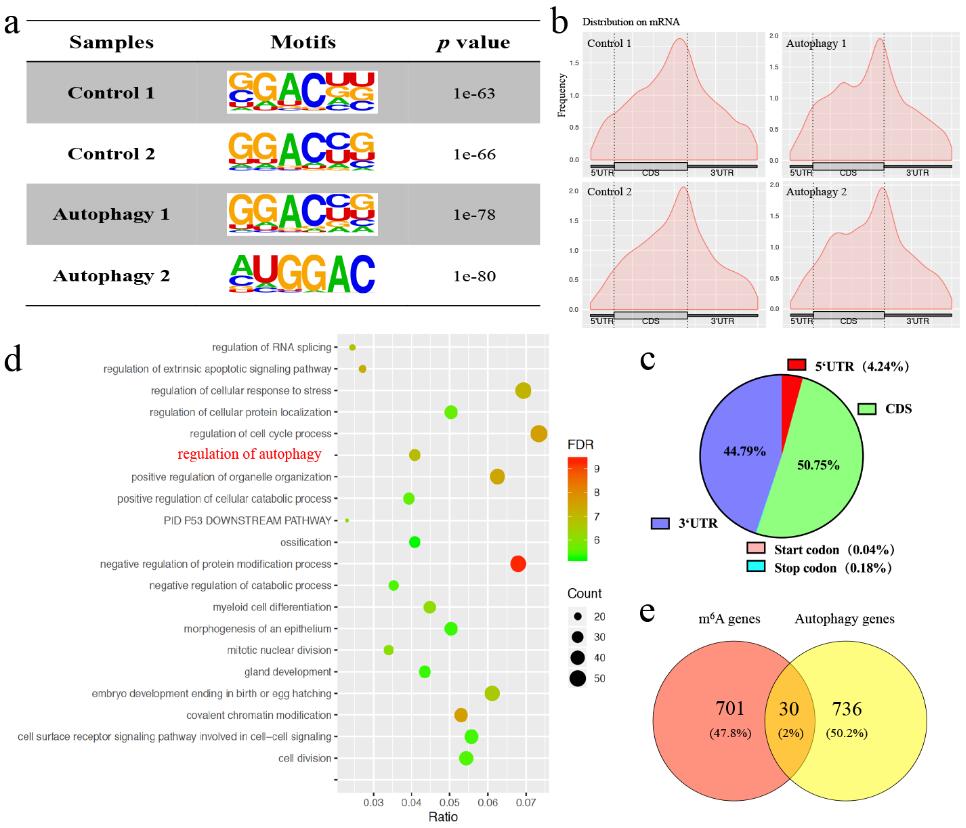
图2.自噬OSCC细胞meRIP-seq结果(表观生物提供技术服务)
30个基因之中,包括了已有研究表明能够抑制自噬的eIF4G1基因。
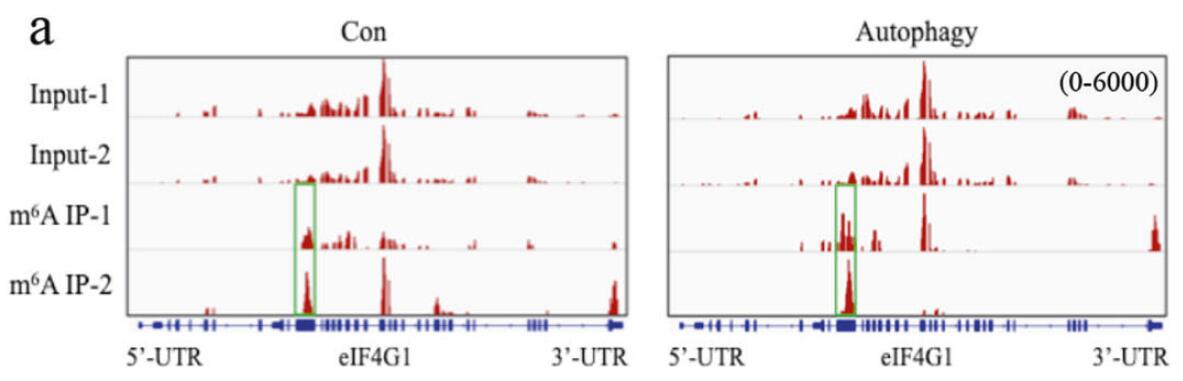
图3. IGV峰图,显示自噬细胞的eIF4G1基因CDS和3’UTR区具有m6A峰
m6A修饰机制研究
于是接下来,就可以愉快地开展针对eIF4G1的基因功能研究了!
首先,可以进一步鉴定eIF4G1的m6A水平变化,这里可以采用m6A-qPCR技术,对特定的基因进行精确的m6A修饰水平定量。
然后,关于m6A修饰如何调控下游基因,有潜在的不同的机制,包括影响基因可变剪切、影响RNA稳定性、影响基因翻译效率等。
小知识
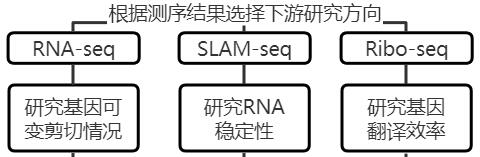
小知识
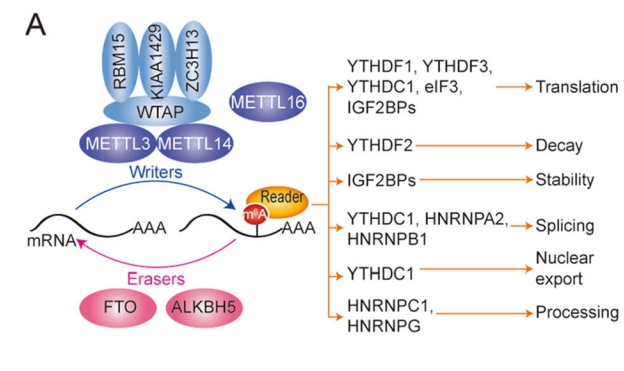
不同的reader跟不同的m6A修饰功能相关[2]
后续研究者还进行了很完整的体内外实验来研究FTO、YTHDF2是如何调控eIF4G1,影响OSCC细胞发展的(具体可看研究思路图)。

图4. 雷帕霉素处理的OSCC细胞中的FTO和自噬的相互作用。FTO通过YTHDF2介导的m6A修饰,增强eIF4G1的稳定性。
总结
这篇文章的研究思路很经典,包括刚接触m6A修饰课题的时候从何入手进行初筛,如何寻找m6A修饰相关蛋白,怎样挖掘m6A修饰调控的靶基因,可以从哪些方面进一步揭示m6A修饰背后的调控机制。
表观生物具有完备的RNA甲基化修饰研究技术服务,比如meRIP-seq、SELECT-m6A修饰定量技术服务与试剂盒(预售中)、ONT Direct RNA全长转录组测序、SLAM-seq以及Ribo-seq等产品,欢迎咨询!
欢迎拨打电话400-775-0875或
识别二维码咨询微信客服!

参考文献:
[1] Wang F, Liao Y, Zhang M, et al. N6-methyladenosine demethyltransferase FTO-mediated autophagy in malignant development of oral squamous cell carcinoma. Oncogene 2021 Jun;40(22).
[2] Nombela P, Miguel-López B, Blanco S. The role of mA, mC and Ψ RNA modifications in cancer: Novel therapeutic opportunities. :Mol Cancer 2021 01 18;20(1).
- - - 推荐阅读 - - -
喜讯!表观生物获中科院Nature级RIC-seq技术成果转化授权
2021-06-23
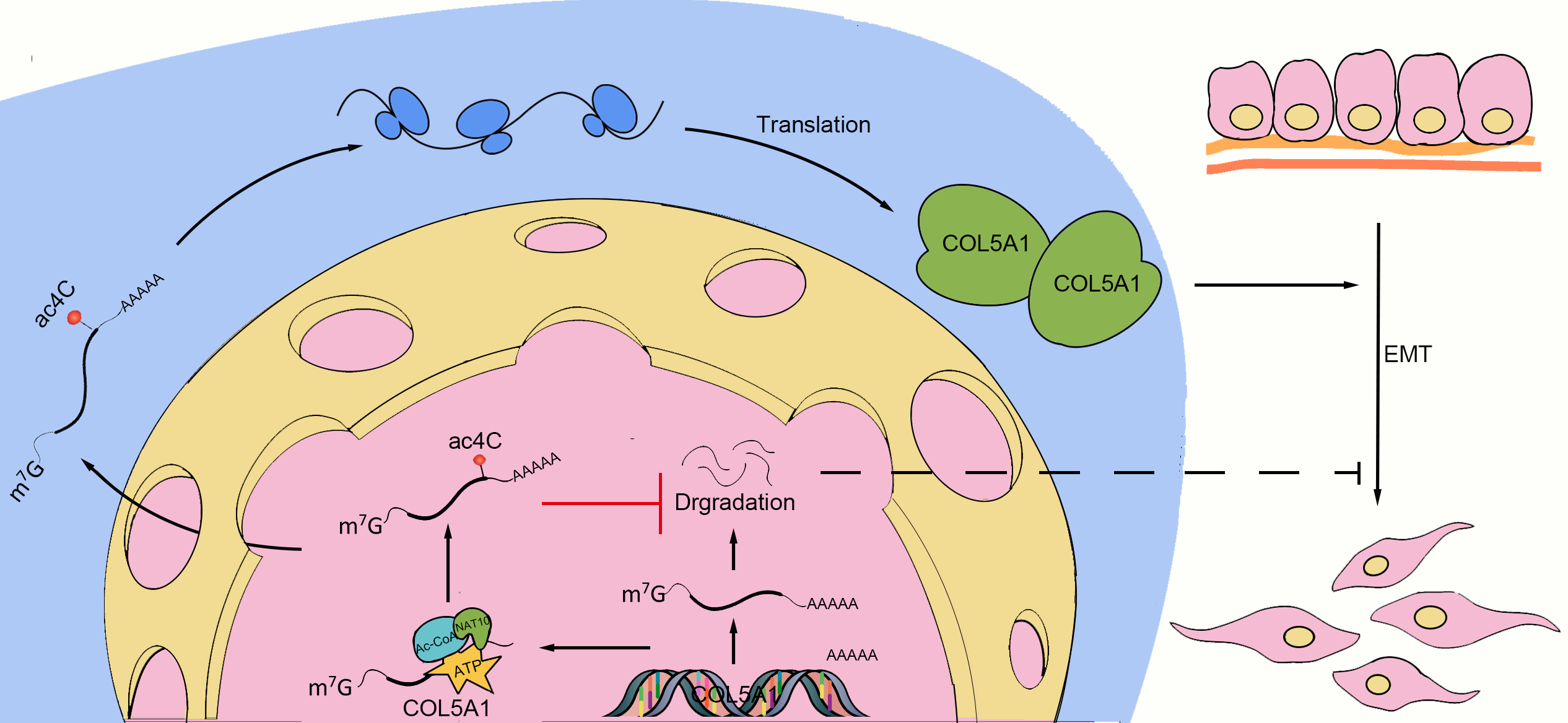
STTT | 兰州大学第一医院李汛团队首次揭示胃癌演进中mRNA乙酰化修饰新机制
该项研究系统阐释了NAT10介导的mRNA 乙酰化修饰促进胃癌细胞上皮—间质转化 (EMT) 和转移的机制作用,为通过靶向干预NAT10和ac4C通路抑制肿瘤演进提供新的策略。
2021-05-08
m6A测三送一!加速m6A研究就趁现在!
广州表观生物科技有限公司是由多位资深生物技术专家共同创办的高新技术企业,为生物医学热门研究方向提供创新的外泌体全转录组测序、超级增强子鉴定、RNA甲基化分析、翻译组测序(Ribo-seq)、CLIP-seq、RNA结合蛋白 Crispr Cas9 文库高通量筛选等高端科技服务项目。
2021-03-31
