客户文章 | Cancer Res:自噬诱导PGCC细胞形成,与鼻咽癌复发相关

期刊:Cancer Research
IF:12.7
发表时间:2022年3月
摘 要
在癌症治疗中残留的休眠癌细胞可能引发癌症的复发或扩散性转移,在多数情况下都是致命的。已有研究表明,特异性休眠多倍体肿瘤巨细胞(PGCC)可能与鼻咽癌复发的临床风险有关。在这项研究中,来自南通大学附属医院的研究团队阐述了PGCC的生物特性,包括其线粒体在癌症治疗中的变化;并且揭示了诱导PGCC形成的一个重要机制——自噬。除此之外,药理层面或基因层面对自噬的抑制,可以显著抑制PGCC的形成,尤其在抑制鼻咽癌转移与提高小鼠模型存活率方面。从机制上讲,化学药物在某种程度损伤了线粒体,导致ATP水平下降,激活了经由AMPK-mTOR通道的自噬行为,最终促进PGCC的形成。基于PGCC的转录以及表观分析揭示了RIPK1的过表达及其支架功能是AMPK-mTOR诱导的PGCC存活所必需的。大量的特异性休眠PGCC,与鼻咽癌患者复发时间变短、存活情况变差有关。上述发现为人们提供了一种针对癌症治疗后潜伏的PGCC的疗法。
关键研究技术
ATAC-seq、CUT&Tag(H3K27ac)、RNA-seq
研究思路
这篇文章的主要研究思路如下图:
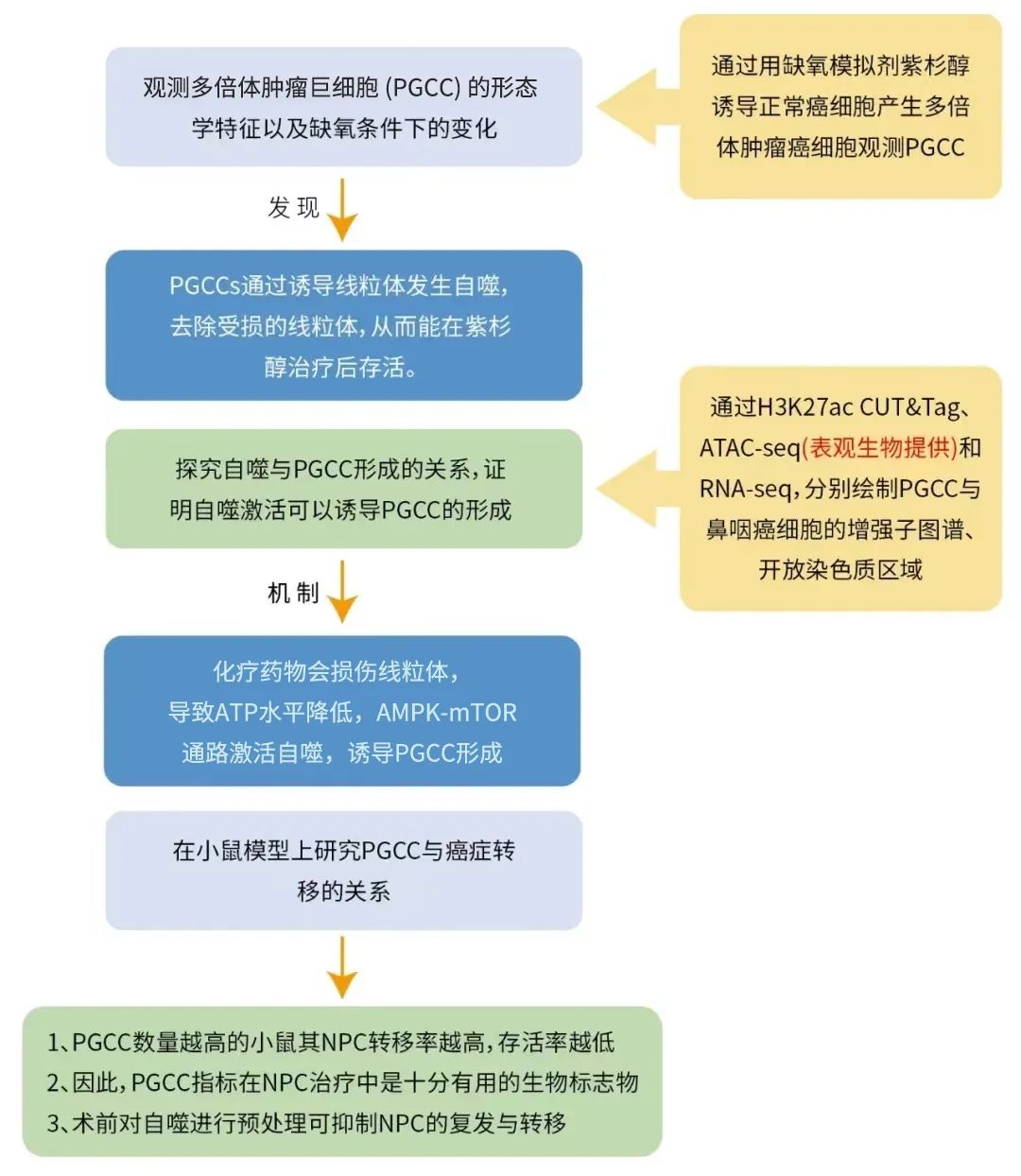
图1. 本研究整体研究思路
自噬诱导PGCC形成
大多数复发和扩散性转移事件是由休眠的癌细胞重新激活引起的。在本项研究中,研究者在对PGCC通过自噬激活剂和自噬抑制剂的对比处理和检测常见的四种自噬通路后发现:
1、自噬激活诱导PGCC形成
2、化疗药物会通过AMPK-mTOR通路激活自噬
因此,自噬所导致的PGCC形成是AMPK-mTOR通路激活的结果。
PGCC增强子图谱
PGCC发生发展的过程中是否涉及表观遗传学机制呢?为了绘制PGCC基因组的增强子图谱,研究者进行了H3K27ac CUT&Tag测序,结合RNA-seq,分别对PGCC细胞和CNE-2(鼻咽癌细胞株)进行分析;
而对于染色质开放区域的评估,则是用到了ATAC-seq,鉴定出12,658个PGCC与CNE-2特异性的峰分别12,658个和27,284个(图2、图3)

图2. ATAC-seq差异表达火山图(由表观生物提供技术服务)

图3. PGCCs和CNE-2细胞的CUT&Tag和ATAC-seq信号TSS分布热图(右图由表观生物提供技术服务)
多组学联合分析发现,通过RNA-seq鉴定的101个转录激活基因可比对到PGCC特异性CUT&Tag和ATAC-seq峰,其中RIPK1的基因表达水平在PGCC中显著增加了7倍,且已被报道与自噬相关(图4),于是研究者选择了RIPK1继续下游研究:
 图4. RIPK1位点处的CUT&Tag和ATAC-seq信号峰
图4. RIPK1位点处的CUT&Tag和ATAC-seq信号峰
之前的研究报道,RIPK1通过激酶依赖和非依赖机制调节两种相反的细胞命运。作为支架,RIPK1通过多种信号通路抑制细胞凋亡和坏死;作为一种激酶,RIPK1又矛盾地诱导细胞死亡。为了评估RIPK1在决定PGCC细胞命运中的作用,研究者检测了pS166 RIPK1的表达,以及进行了挽救实验,证明RIPK1被转录激活之后,作为支架,通过AMPK-mTOR通路阻止PGCC死亡,而不是作为激酶。
临床样本分析
最后,研究者通过对临床患者的样本分析发现,高PGCC水平与鼻咽癌复发相关,PGCC数量高的患者显示出较高的复发率(P<0.0001)和较差的临床结果(P¼0.0002),表明在鼻咽癌治疗前,PGCC数是预测未来转移、复发率、复发时间和患者生存率的一个有价值的生物标志物。
总结
本研究通过CUT&Tag和ATAC-seq绘制PGCC细胞的增强子图谱和开放性区域图谱,鉴定出PGCC发生发展过程中起关键作用的基因RIPK1,助力病理机制的研究,也有望成为新的鼻咽癌诊疗标志物。
表观生物具有完备的肿瘤核心调控元件研究方案,深入机制,助力肿瘤防控!技术体系包括CUT&Tag、ChIP-seq、ATAC-seq、RIC-seq、HiChIP、RADICL-seq等,适用于绘制肿瘤相关增强子、eRNA图谱及调控网络,寻找非编码区致病突变及关联,欢迎咨询!
图5. 肿瘤核心调控元件研究思路及相关技术
欢迎拨打电话400-775-0875或
识别二维码咨询微信客服!

参考文献:
You B, Xia T, Gu M, et al. AMPK-mTOR-Mediated Activation of Autophagy Promotes Formation of Dormant Polyploid Giant Cancer Cells. Cancer Res 2022 Mar 01;82(5).



