ACC-seq:全基因组范围检测染色质结合凝聚体的新型技术
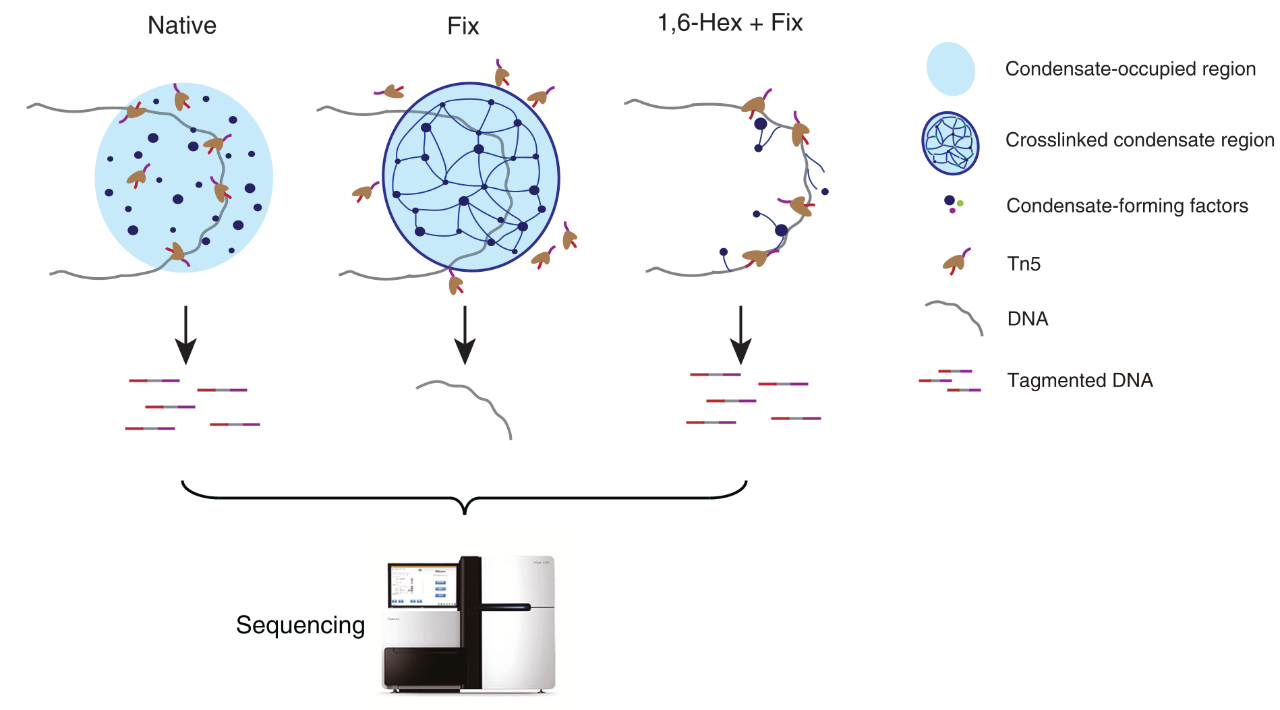
图1. ACC-seq技术原理
技术原理
ACC-seq是利用Tn5转座酶在不同凝聚体调节条件下对DNA片段的可及性差异来识别凝聚体占位区域。三个核心步骤为使用不同的处理方式调节染色质凝聚体状态:
①Native:不做任何处理,保持细胞内凝聚体的自然状态;
②Fix:使用甲醛固定细胞,将凝聚体与其结合的DNA交联固定;
③1,6-Hex+Fix:先使用1,6-己二醇处理细胞,破坏凝聚体结构并释放其结合的DNA,然后再进行固定。
对这三种不同处理方式处理的样本分别使用Tn5转座酶进行切割。由于凝聚体会阻碍Tn5转座酶对DNA的切割,因此再凝聚体占位区域,Fix样本的DNA可及性会降低,而1,6-Hex+Fix样本的DNA可及性会恢复。最后对切割后的DNA片段进行高通量测序。
技术应用
1.全基因组范围内识别染色质结合凝聚体的占位区域
2.研究染色质结合凝聚体对基因表达的影响
3.结合其他测序和成像技术,研究凝聚体形成TFs的特性和功能
4.分析与疾病相关的TF变异对凝聚体形成和转录调控的影响
5.发现并表征新的染色质结合凝聚体
技术优势
1. 灵敏度高,能够识别由直接DNA结合蛋白形成的凝聚体,捕捉细微的调控变化,可检测到由少量TF分子形成的小凝聚体
2. 通过凝聚体调节条件下的差异可及性模式,有效区分凝聚体占位区域,排除假阳性信号
3. 实验流程相对简单,易于操作,细胞量需求低
4. 能够提供凝聚体形成TF的结合位点、表达水平和功能信息
送样要求
样本类型:
1. 活细胞,≥1.5×105个细胞/样本
2. 按照表观《一步法ACC-seq建库前处理》处理细胞,Native组、Fix组、1,6-Hex+Fix组,每组5×104个细胞
样本物种:仅限人、大小鼠,其他物种需评估
样本物种:仅限人、大小鼠,其他物种需评估
基础分析
1.测序原始reads去接头,质量控制(QC)
2.参考基因组比对(Mapping)
3.富集区域鉴定(PeakCalling)
4.hex-released开放区域
5.Peak注释
6.Peak相关基因GO分析
7.Peak相关基因KEGG分析
8.富集区域motif分析
9.组间差异Peak相关基因筛选与GO功能聚类分析、KEGG分析
高级分析
1.Dual action TFs预测
2.合并TSS富集热图
3.GOKEGG圈图
4.IGV峰图(附5个基因)
分析内容
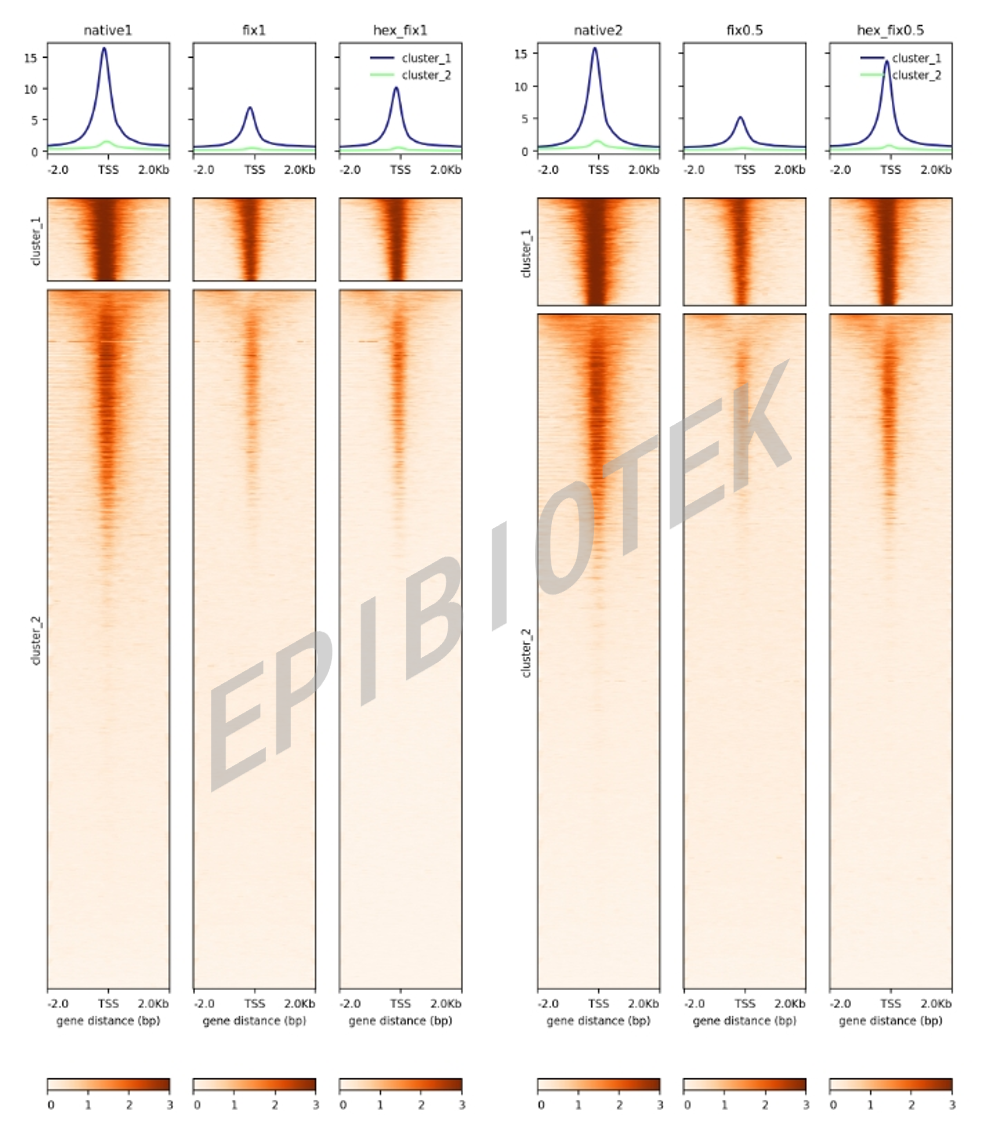
图2. ACC-seq信号富集热图(具有U形结构)
表观生物实测数据
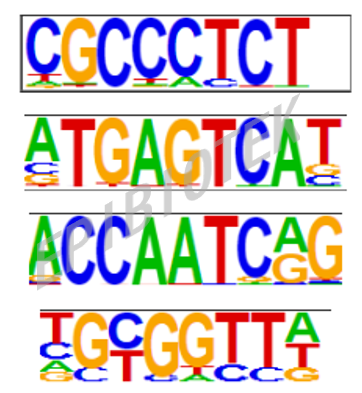
图3. Motifs分析:预测Dual action TFs
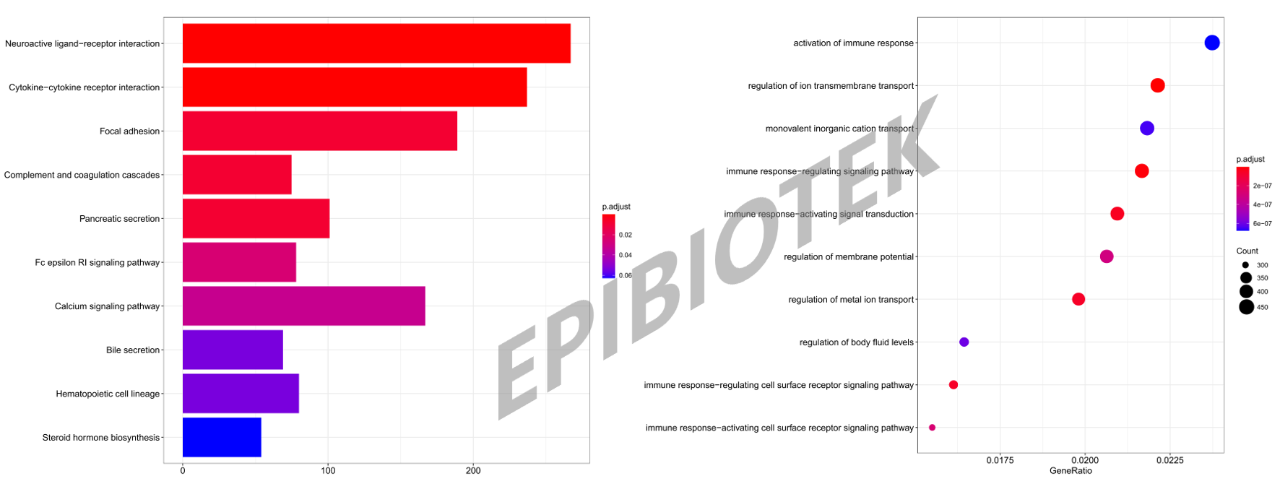
图4. KEGG通路分析条形图和GO富集分析气泡图
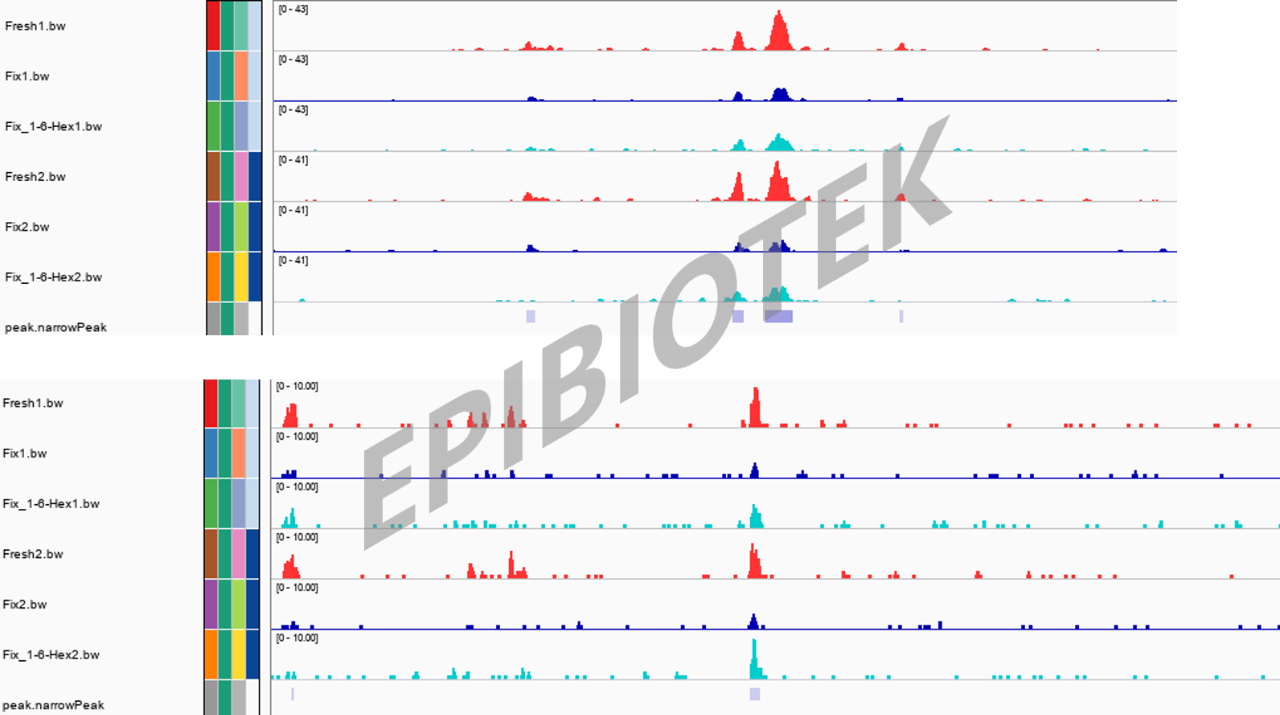
图5. IGV峰图
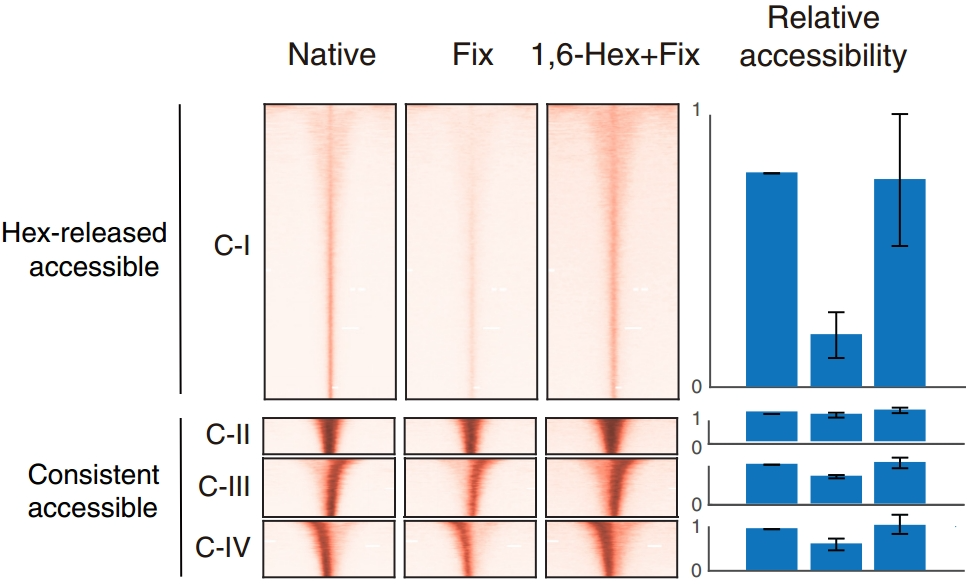
图6. ACC-seq不同实验条件下的DNA可及性模式变化
案例研究
He et al., Dual-role transcription factors stabilize intermediate expression levels, Cell (2024)[1]
这项研究利用开发的ACC-seq来检测染色质结合的凝聚体,并通过该技术对mESC中的染色质凝聚体进行了全基因组范围的分析。通过比较不同的实验条件(Native、Fix、1,6-hex+Fix)的染色质可及性差异,可以识别出染色质结合凝聚体的占位区域。通过ACC-seq发现了一类新的双重作用转录因子(dual-action TFs),能够通过形成凝聚体来调节基因表达。且发现dual-action TFs在mESC的正常发育和干细胞维持中发挥重要作用,其功能失常会导致发育缺陷。
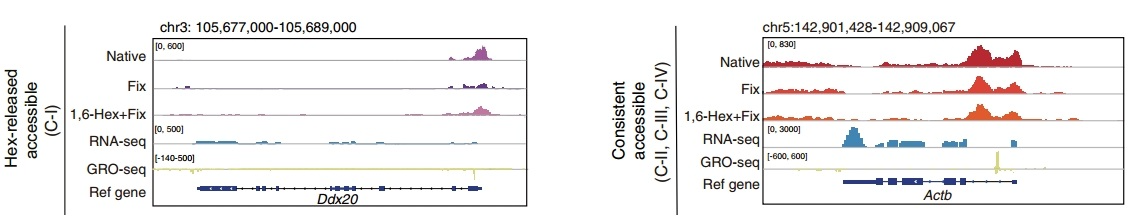
图7. ACC-seq与RNA-seq、GRO-seq对比的IGV峰图
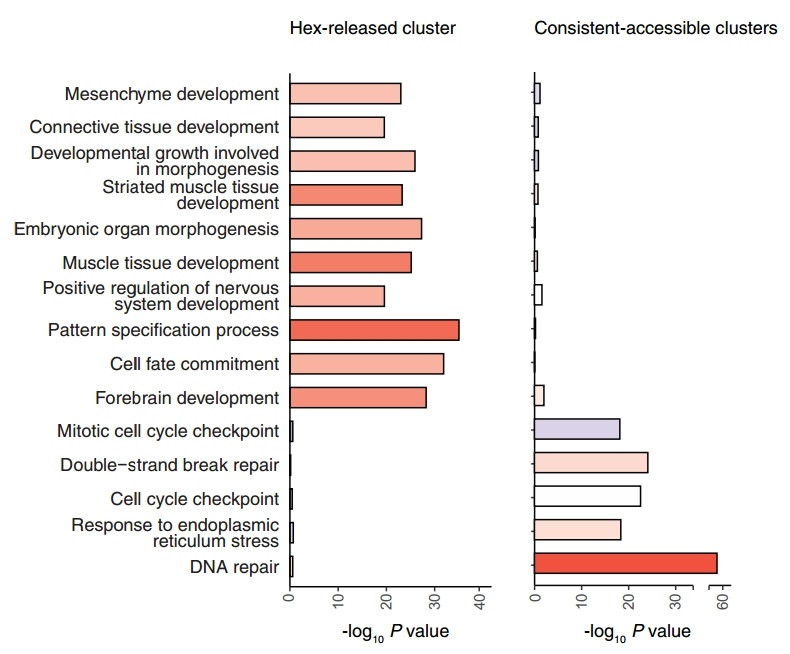
图8. Hex-released和Consistent-accessible簇的KEGG通路分析条形图

图9. Hex-released开放性区域TF motifs富集(左);预测的IDR75和疏水残基(右)
参考文献
1. He J, Huo X, Pei G, et al. Dual-role transcription factors stabilize intermediate expression levels. Cell. 2024;187(11):2746-2766.e25.
