单细胞转录组测序研究方案
1.立项依据
1.1研究背景
伴随着医学技术的发展,疾病已经初步进入了个体化治疗阶段。从2009年研究人员对小鼠单个四细胞胚胎期转录组进行单细胞水平分析[1];到2011年一种肿瘤研究新方法单细胞测序技术(single cell se⁃quencing,SCS)的出现[2];再到2013 年,研究人员首次对病人外周血循环肿瘤细胞(circulation tumor cell,CTC)进行单细胞测序[3],SCS测序逐渐成为一种成熟的医学技术手段,为科学家从不同的视角揭示细胞不同阶段的功能和特性提供思路。SCS主要包括转录组测序,基因组测序,表观遗传测序和多组学测序。应用最广泛的单细胞转录组测序,它可获得特定组织中所有状态下的转录本。目前为止测序结果绝大多数是对细胞团或组织块进行的混合分析,它反映的是样本中优势细胞的信息。但是细胞往往具有异质性,会导致低丰度的信息丢失掉[4]。因此SCS对丢失低丰度信息的多细胞测序有很好的补充,目前SCS已经应用到肿瘤,遗传学和免疫学等研究领域中[5]。
2.研究目标
目标一、分析正常人和病人组织中细胞亚群的异同;
目标二、分析细胞亚群中marker基因;
目标三、分析细胞分化的轨迹;
3.研究内容
内容一、获得正常人及病人样本组织中的单细胞;
内容二、对质控后的单细胞测序数据进行分选;
内容三、分析细胞亚群中的基因转录信息;
内容四、对单细胞测序数据进行GO/KEGG分析;
内容五、细胞轨迹的分化重建分析。
4.创新点和拟解决的关键科学问题
4.1创新点
目前生命科学研究中有很多问题难以解决,比如无法分析肿瘤异质性的样本中单细胞的信息,无法深入探究胚胎发育过程中的发育机制,无法分析免疫细胞在不同组织中的转录状态。而单细胞测序分析可以很好的解决此类问题,可以高分别率的获得单个细胞转录状态,可以分析不同之间段不同组织中的细胞亚群变化。这将从新的角度新的层次深入探究疾病的发生发展过程,为生命科学的研究探索更深机制。
4.2拟解决的关键科学问题
问题一、病人病灶组织中细胞亚群有哪些种类?
问题二、病人病灶组织中细胞亚群较正常人有哪些变化?
问题三、病人病灶组织中是否有新的亚群和新的标志基因?
问题四、病人病灶组织中的亚群是怎样的变化过程?
5.研究方法及技术路线图
5.1研究方法
• 送样要求
细胞数量和浓度:建议大于5×105个,浓度为1000个/μL
细胞尺径:5μm ≤ X ≤ 40μm
细胞活性:活细胞大于90%
细胞悬液不能含有Mg2+和Ca2+等影响酶活性的物质。
单细胞转录组高通量测序是基于二代测序平台的基础上进行的测序,但其整体流程有别于二代测序,如下图1。
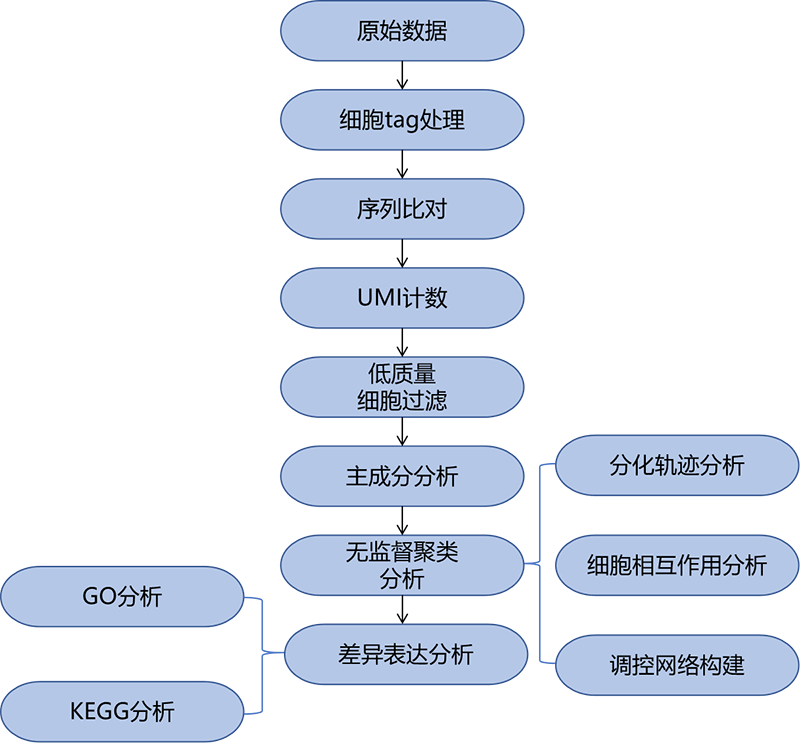
图1:单细胞转录组测序分析流程
5.2技术路线图
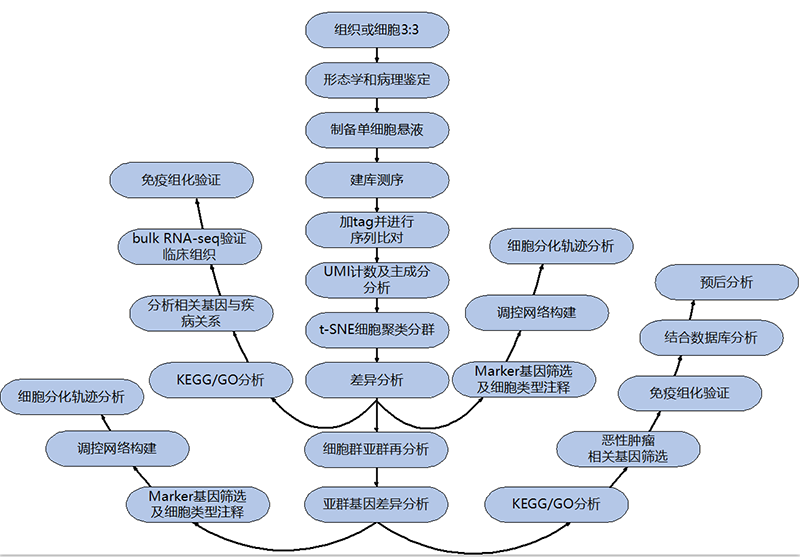
图2.单细胞转录组测序技术路径
6关键技术
6.1 技术原理
将组织内细胞分离出来并同细胞标签共同孵育,然后对带标签的细胞进行计数和活力检测。然后将单个细胞和磁珠进行孵育并洗去多余的磁珠,进而将细胞裂解并进行反转录和扩增建库,建库后即可进行测序。对含有标签序列的数据进行质控筛选,并拆分数据为每个细胞一组。对拆分后的数据进行定量分析并分选出不同的细胞亚群,然后根据模型进行细胞轨迹分析用于后续实验探究。
6.2 分析内容

图3.单细胞测序及生物信息分析内容
6.3主要结果展示及意义解读
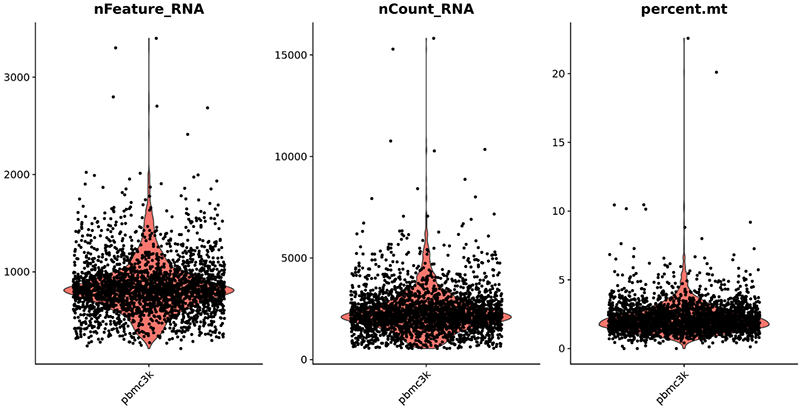
(1)低质量细胞过滤:
去除低质量信号的细胞可以较少技术噪音,便于后续生物通路等信号分析。低质量细胞的过滤也包括基因的过滤:去除在任何细胞里都没信号的基因、含有极少量reads的细胞及表达量被认为是没检测到或洗脑极低的基因,如下图4所示(图片来自:https://satijalab.org/seurat/v3.1/pbmc3k_tutorial.html)。
图4:单细胞测序数据质控分析
(2)主成分分析:
机体组织中通常含有多种成分,而且不同成分之间常具相关性。在这种情况下不同成分之间的信息会有重叠,使得样本的分析比较复杂。从这种复杂的关系中重新整合出无相关的几个综合的含有样本尽可能多信息的指标,这种统计方法称为主成分分析。如下图5所示(图片来自Nature Communication)

图5:主成分分析
(3)无监督聚类分析:
根据主成分分析的结果,对组织内的细胞进行聚类分析得到不同类型的细胞群。可以结合不同类型细胞群和生物学理论推理程病理进程,如下图6所示(图片来自Nature Communication 10.1038/s41467-017-02554-5)
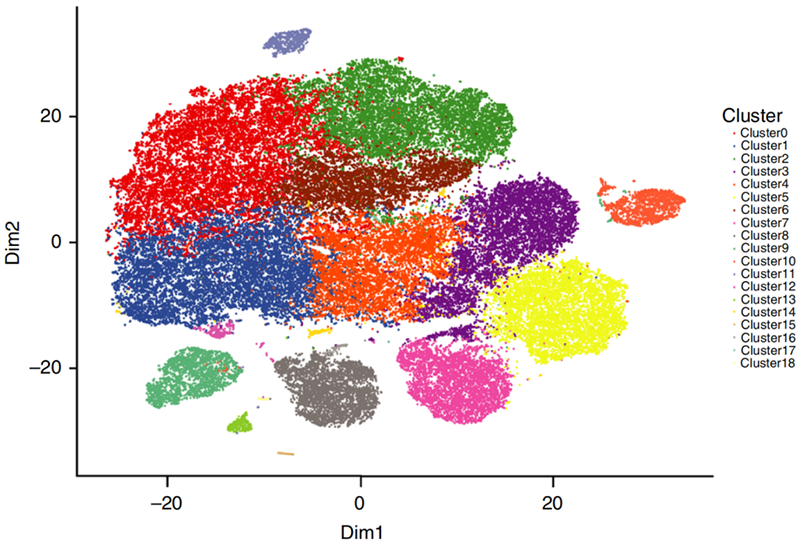
图6:t-SNE细胞亚群聚类分析
(4)细胞类型注释:
聚类后的细胞群被认为不同的细胞类型,但不进行定义并不知道是什么类型细胞。因此需要对细胞群里的基因进行注释并结合生物学知识或数据库对细胞群进行定义,如下图7所示(图片来自Science DOI: 10.1126/science.aay3224 )
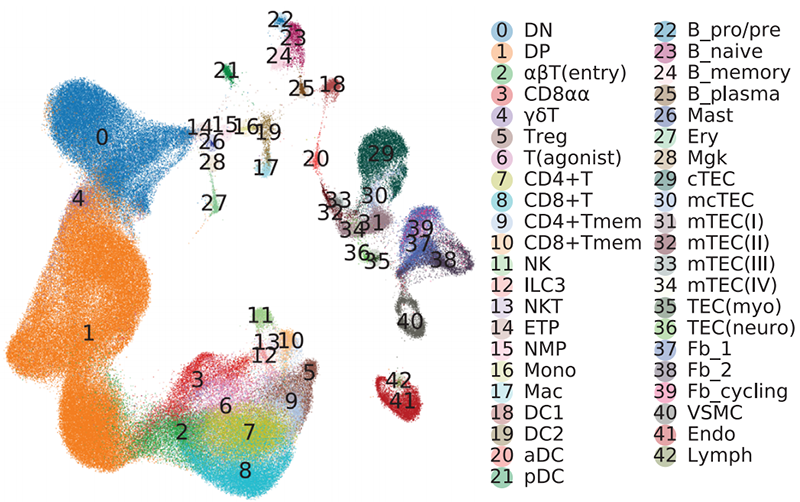
图7.细胞类型注释
(5)细胞亚群再分群分析:
细胞分群后对不同的亚群进行进一步的分析,可根据研究目的选择目的细胞群进行分析,筛选出与疾病相关的亚细胞群并进行富集分析,为下一步验证提供参考,如下图8所示(图片来自Science DOI: 10.1126/science.aay3224)
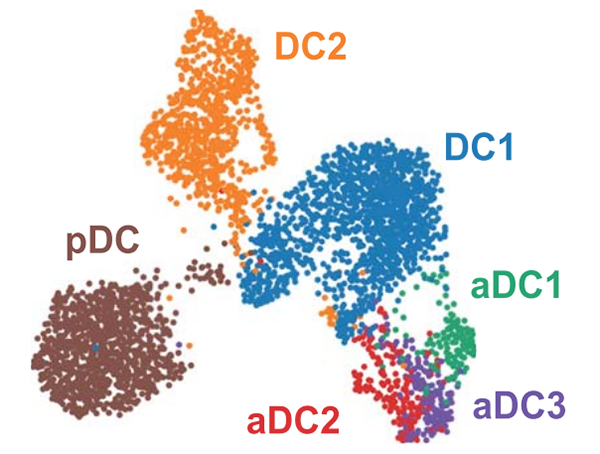
图8:树突状细胞群亚群分析
(6)差异分析:分析正常人和病人样本细胞群中基因的表达情况,可结合病理分析判断基因差异与疾病的关系,如下图9所示。
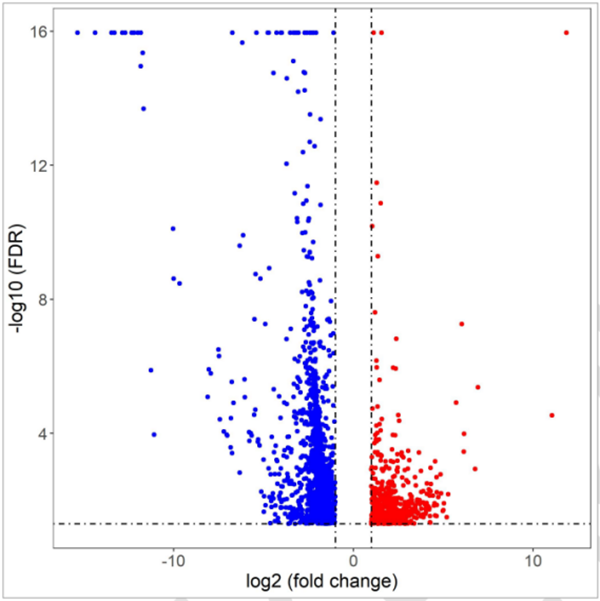
图9:差异表达基因分析
(7)细胞间相互作用分析:
在组织细胞内每种细胞之间存在信息传递的作用,主要以配体和受体的相互作用相互调控。而这些配体受体的变化体现在他们的基因表达水平上,因此根据数据库里的信息可以分析有哪些配体受体发生了变化,从而分析他们的调控网络,如下图11所示(图片来自Science DOI: 10.1126/science.aay3224)。
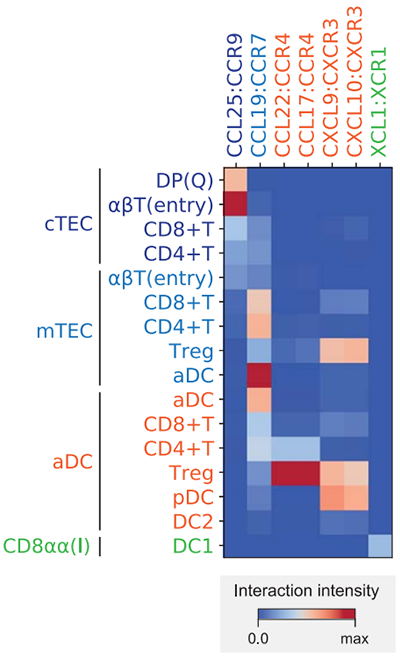
图11:细胞间相互作用分析
(8)细胞内基因调控网络分析:
细胞内基因表达变化会影响胞内其他相关基因的变化,从而导致细胞表型的变化最终引起疾病症状。这些变化基因之间的相互调控可以通过生信分析得到调控网络图,从而可视化的展示出这些相互作用便于后续分析研究,如下图12所示。
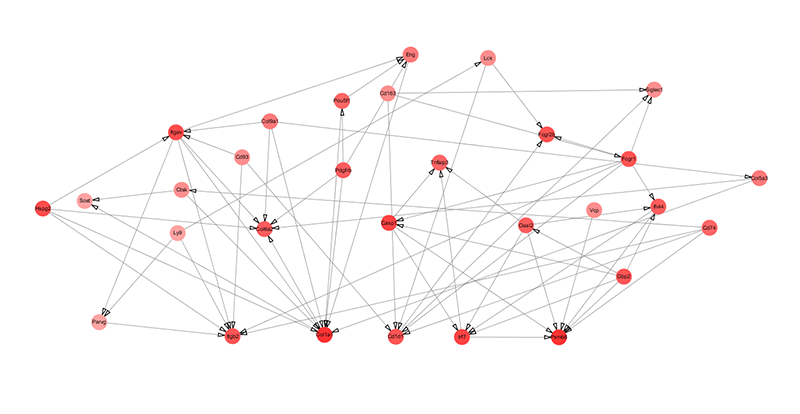
图12:蛋白调控网络分析
(9)细胞拟时分析:
在细胞分化时细胞内的基因表达发生变化,即细胞群间的基因表达会发生变化。根据基因的变化推断细胞群是怎样进行分化做一个拟时分析,对于探究疾病的发展过程机制极为重要,如下图13所示(图片来自doi:10.1136/annrheumdis-2019-215926)
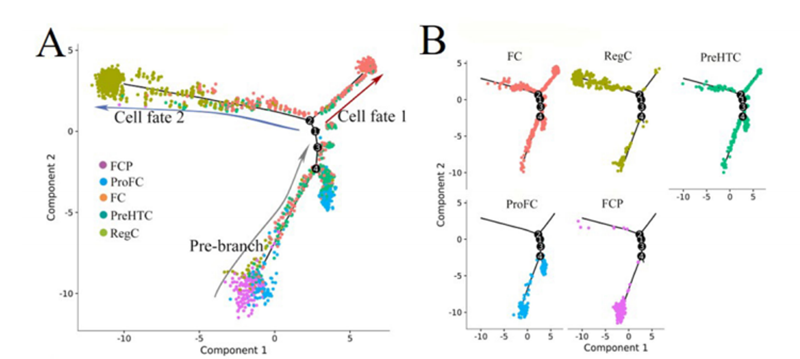
图13:T细胞分化轨迹分析
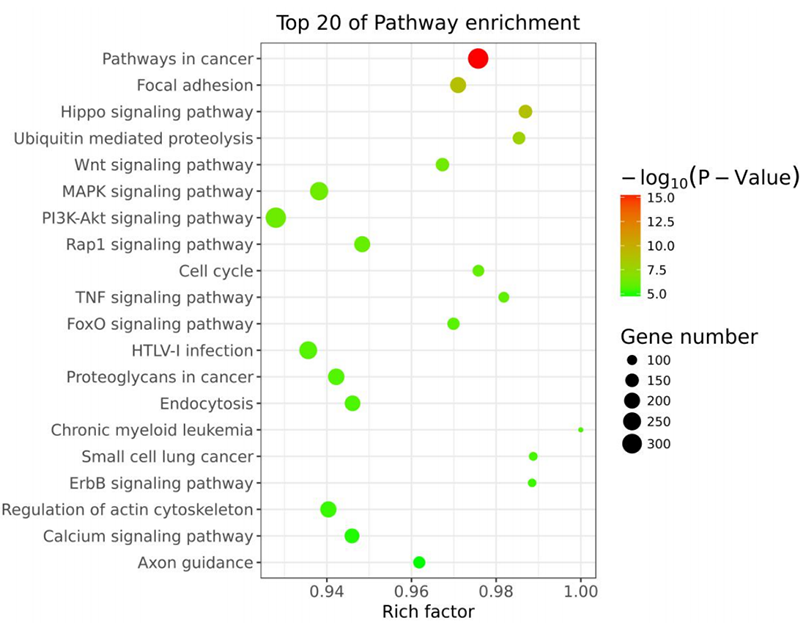
(10)KEGG分析:
KEGG分析的关键在于拥有完备的数据库和较完整的Pathway注释。分析结果中的相关基因是在实际信号通路中存在关系的。相对于GO分析,KEGG分析更为直接的让研究者可以很好地对于目标基因进行研究。信号通路分析的目的是基于KEGG数据库去寻找差异翻译效率基因显著性富集的信号通路。
每一个Pathway分析的结果需要由三个Sheet来进行结果展示。分别为A1llPathway_Result,AllPathway2Gene以及AllGene2Pathway。这三个部分结果,分别记录了显著性Pathway分析情况,每一个Pathway-Term所对应的基因情况以及每一个基因所从属的Pathway-Term的情况,如下图14所示。
图14:差异表达基因KEGG分析
(11)GO分析:
GO分析从细胞的生物学进程(Biological Process)、分子功能(Molecular Function)和细胞组分(Cellular Component)三个层面对有差异翻译效率的基因进行功能注释。GO分析采用Fisher检验计算每个GO的显著性水平(P-Value),从而筛选出显著性GO。从生物学意义的角度来看,Biological Process更为贴近表型,往往可以很好地描述样本的实际情况。Cellular Component往往用于描述基因在细胞上的定位信息,当研究者关注在一些特殊的亚细胞定位研究的时候具有重要的意义。Molecular Function往往用与描述蛋白的实际作用方式,当研究者非常关注整个生物进程中蛋白作用方式的变化时,可以考虑从这个角度切入,如下图15所示。
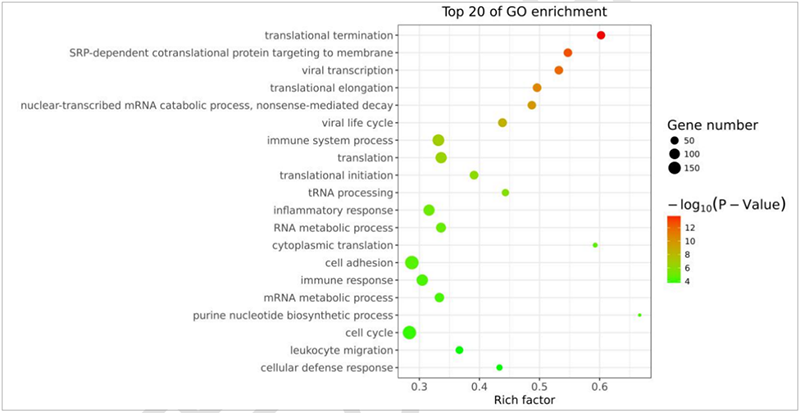
图15:差异表达基因GO分析
参考文献
[1]Tang F,Barbacioru C,Wang Y,et al. mRNA⁃Seq whole⁃transcriptome analysis of a single cell[J].Nat Methods,2009,6(5):377⁃382.
[2]NavinN,Kendall J,Troge J,et al. Tumour evolution inferred by single⁃cell sequencing[J]. Nature,2011, 472(7341):90⁃94.
[3]李金明. 实时荧光 PCR 技术[M]. 北京:人民军医出 版社,2014:240⁃255.
[4]Shirai M,Taniguchi T,Kambara H. Emerging applications of single⁃cell diagnostics[J]. Top CurrChem,2014,336:99⁃116.
[5]WANG J,SONG Y. Single cell sequencing:A distinct new field[J]. Clin Transl Med,2017,6(1):10.
[6]Vogelstein B, A.Strillacci,C.Griffoni,et al,RNAi-based strategies for cyclooxygenase-2 inhibition in cancer[J]. J Biomed Biotechnol,2010(8):28-45.
[7]Peter C Kurniali, Borys Hrinczenko, Anas Al-Janadi,et al. Management of locally advanced and metastatic colon cancer in elderly patients[J]. World J Gastroenterol,2014,20(8): 1910-1922.
[8]L. Zhang, S. Wu, L.R. Guo, et al. Diagnostic strategies and the incidence of prostate cancer: reasons for the low reported incidence of prostate cancer in China. Asian J Androl ,2009(11):9-13.
[9]ORTEGA M A,POIRION O,ZHU X,et al. Using single-cell multiple omics approaches to resolve tumor heterogeneity[J]. Clin Transl Med,2017,6(1):46.
[10]Gaublomme JT, Yosef N, Lee Y, et al. Single-cell genomics unveils critical regulators of Th17 cell pathogenicity[J]. Cell, 2015, 163(6): 1400-1412.
[11]Shalek AK, Satija R, Adiconis X, et al. Single-cell transcriptomics reveals bimodality in expression and splicing in immune cells[J]. Nature, 2013, 498(7453): 236-240
[12]Islam S, Zeisel A, Joost S, et al. Quantitative single-cell RNA-seq with unique molecular identifiers[J]. Nat Methods, 2014, 11(2): 163-166.
[13]Bjorklund AK, Forkel M, Picelli S, et al. The heterogeneity of human CD127(+) innate lymphoid cells revealed by single-cell RNA sequencing[J]. Nat Immunol, 2016, 17(4):451-460.
[14]LASKEN R S,MCLEAN J S. Recent advances in genomic DNA sequencing of microbial species from single cells[J]. Nat Rev Genet,2014,15(9):577-584.
[15]GILBERT J A,QUINN R A,DEBELIUS J,et al. Microbiome-wide association studies link dynamic microbial consortia to disease[J]. Nature,2016,535(7610):94-103.