Cell Stem Cell | 可变剪接改变干细胞维持和神经元分化的转录调控
以往研究表明,RNA结合蛋白PTBP1和PTBP2可通过控制可变外显子的剪接调控神经转录、凋亡、轴突生成和突触发生等多个过程【1,2】。染色质重塑复合物BRG1/BRM-关联因子 (BAF) 与胚胎干细胞多能性、自我更新和神经元命运决定相关【3-5】。然而,在胚胎干细胞发育至神经元的过程中,转录、剪接和翻译间的关联还不为人知。
近日,来自加州大学洛杉矶分校免疫学和分子遗传学系的Douglas L. Black团队在Cell Stem Cell上发表了题为Alternative splicing of a chromatin modifier alters the transcriptional regulatory programs of stem cell maintenance and neuronal differentiation的文章。文章解析了染色质修饰元件、BAF亚单元——DPF2的可变剪接改变带来的分子层面和功能层面的影响,发现其转录本异构体的转变与干细胞维持和神经发育的转录和染色质调控相关。

作者首先发现,在小鼠的多种组织中,Dpf2中的7号外显子只在小鼠脑组织和肌肉组织中检测到,在心脏组织中约占比50%,而在其他组织中则完全不包含。对已发表的RNA测序数据进行分析,作者发现Dpf2中的7号外显子在小鼠胚胎干细胞中完全被跳过,在神经前体细胞中微弱表达,而主要表达在体外分化了5天的皮质神经元中。以上现象提示Dpf2中的7号外显子的剪接具有组织和发育时期的特异性。于是作者对其背后的剪接机制进行研究,发现7号外显子的排除或纳入主要受到RNA结合蛋白PTBP1和弱5’剪接位点的共同调控,且这种发育过程中的调控在脊椎动物中具有保守性,提示其可能发挥着重要的功能。
随即作者对Dpf2中的7号外显子的剪接差异而产生的两种转录本异构体(DPF2-S和DPF2-L)的功能进行研究。采用CRISPR-Cas9基因组编辑技术,作者靶向敲除了7号外显子产生了只表达DPF2-S的细胞,定向获得了表达DPF2-L的细胞。利用筛选出的细胞克隆,作者对神经分化(从胚胎干细胞到神经前体细胞再到神经元)过程进行研究,发现在不同的分化阶段,DPF2的两种转录本异构体的功能不同,DPF2-S影响与胚胎干细胞多能性相关的基因,DPF2-L影响与神经元特化相关的基因。可变剪接是生物表型多样性的重要基础之一。DPF2的两种转录本异构体也驱动了干细胞和神经元的差异细胞表型。表达DPF2-L的克隆通常是扁平的,并且占据了培养基表面的面积明显更大,其中一群中多能性marker的表达降低,而表达DPF2-S的克隆分化为的神经元数量减少,而增殖上升。
那么DPF2的两种转录本异构体是否与BAF复合物相关联呢?作者在胚胎干细胞系中表达了带标签的DPF2-S/DPF2-L,并对染色质进行免疫沉淀。他们发现在小鼠胚胎干细胞中,有445个基因组位点倾向于与DPF2-S结合,有721个位点倾向于与DPF2-L结合。其中,DPF2-S具有对AT核苷酸丰富的区域和可结合多能转录因子的区域的结合偏好,而DPF2-L具有对GC核苷酸丰富的区域和其他转录因子的区域的结合偏好。在神经前体细胞中,作者通过ChIP-seq实验和ATAC-seq的数据分析发现,DPF2-S和DPF2-L靶向的调控区域存在差异,且其调控的表达也可能完全相反。DPF2-S与存在增强子特异修饰(如H3K4me1和H3K27ac)的染色质位点相结合,而DPF2-L与存在启动子修饰(如H3K4me2, H3K4me3和H3K9ac)的位点相结合。以上说明,在某些基因组位点,每种异构体都倾向于招募具有不同基因组功能的染色质重塑BAF复合物。
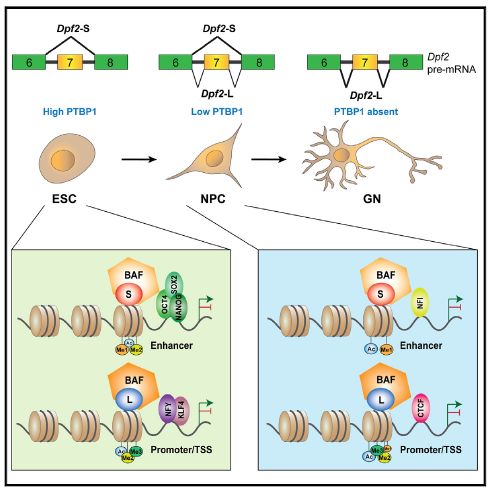
综上,文章发现PTBP1控制DPF2的剪接,在发育的早期,其抑制Dpf2的7号外显子产生DPF2-S转录本,而在神经分化阶段PTBP1缺失,7号外显子被包含,进而产生DPF2-L转录本。这种差异导致了细胞表型和基因表达的不同,进而影响神经发育过程中的染色质组织结构。
原文链接:
https://doi.org/10.1016/j.stem.2024.04.001



