Gut: 复旦大学研究团队发现血浆细胞外囊泡长链RNA谱应用于胰腺导管腺癌的诊断
细胞外囊泡(extracellular vesicle, EV)是一种由活细胞分泌的纳米级别小囊泡,通过运输核酸和蛋白等活性分子来介导细胞间的通讯。细胞外囊泡及其内容物具有组织特异性并且可以反映其母细胞的特征,因而成为疾病诊断及监测理想的生物标志物。越来越多的研究表明,细胞外囊泡可参与疾病的发生发展,尤其是在肿瘤研究领域有望成为新的生物标志物和诊疗靶点,成为目前的研究热点。近日,来自复旦大学的研究团队在《Gut》发表论文揭示了胰腺导管腺癌(PDAC)血浆细胞外囊泡长链RNA(exLR)表达谱,并鉴定了8个exLRs用于诊断胰腺导管腺癌。

作者首先通过电镜、纳米流式仪、western bolt等方法,证实了分离的细胞外囊泡(EV)主要由外泌体(exosomes)组成。随后对100名慢性胰腺炎(CP)患者和284名PDAC患者进行了exLR-seq测序。在每个样本中检测出大约 15000 个注释的gene,包括 mRNA、lncRNA 和假基因,并且这些不同类型的RNA数量的分布在三组之间没有显著差异。使用t-SNE生成的三维数据散点图显示,PDAC患者的exLR与健康个体和某些CP患者存在差异。进一步鉴定出399 个差异表达的 exLRs,基于399差异靶点的无监督聚类分析可以明显区分开PDAC和对照组。KEGG通路富集分析显著富集了癌症相关的通路 (pancreatic cancer, pathways in cancer, mTOR signalling pathway andVEGF signalling)。此外,GSEA对PDAC相关基因进行基因集富集分析显示该基因集在PDAC患者中显著富集。以上的分析结果,提示exLRs具有作为检测PDAC生物标志物的潜力。
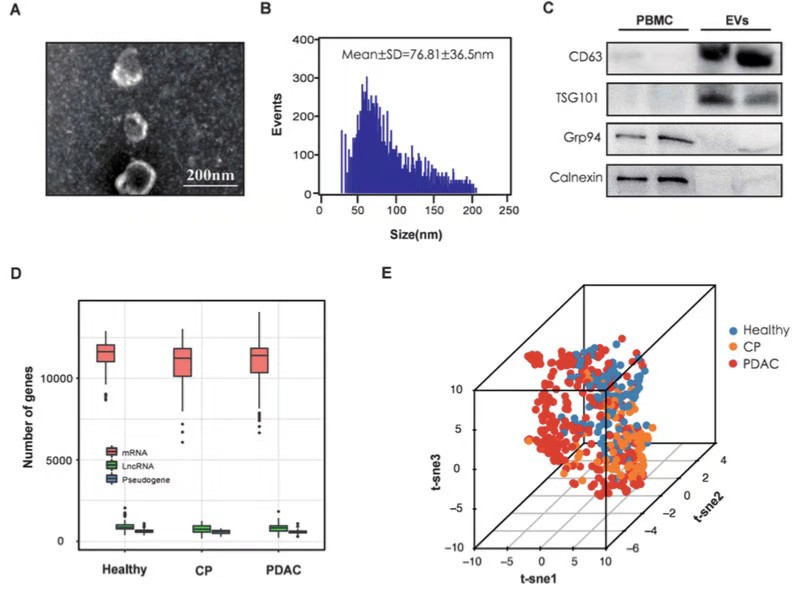
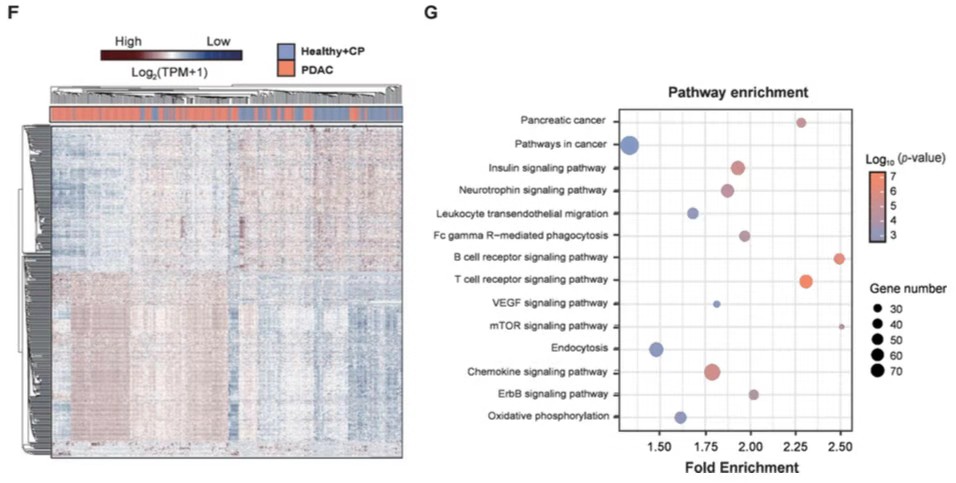
EV的分离鉴定和exLR-seq的检测结果
作者接下来开始建立PDAC的诊断模型。过滤掉检测频率低于25%的exLRs靶点之后,首先在训练集(Healthy=51; CP=16; PDAC=121)中筛选PDAC中高表达的exLR靶点,并通过TCGA数据库中PDAC样本和GTEx数据库中正常组织对比分析得到的癌症高表达靶点,取两者的交集,对模型特征进行第一次缩减。接着结合LASSO和随机森林算法对模型特征进行第二次缩减,并通过注释等得到8个exLRs用于PDAC分类器的建模(FGA,KRT19, HIST1H2BK, ITIH2, MARCH2, CLDN1, MAL2 and TIMP1)。作者采用了支持向量机(SVM)算法基于8个exLRs靶点得到了PDAC诊断模型以及exLR d-signature。
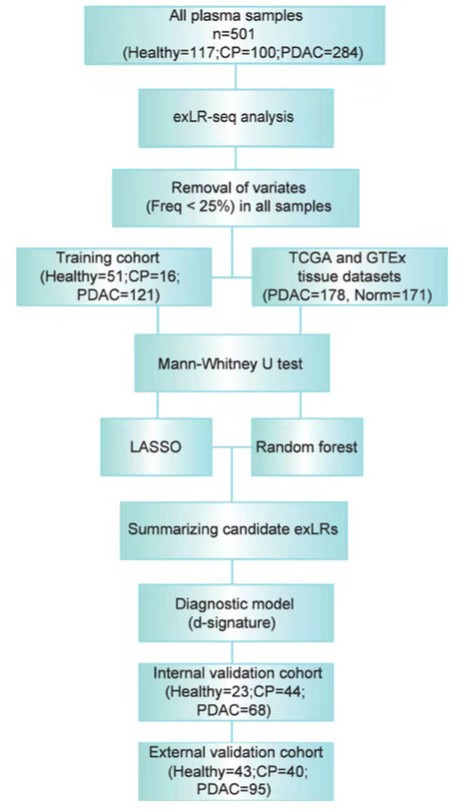
数据分析及模型构建流程
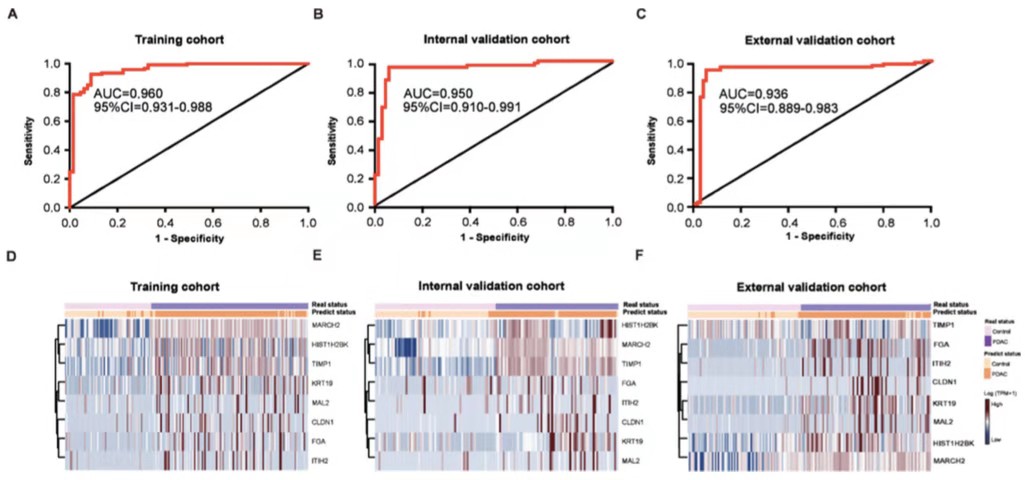
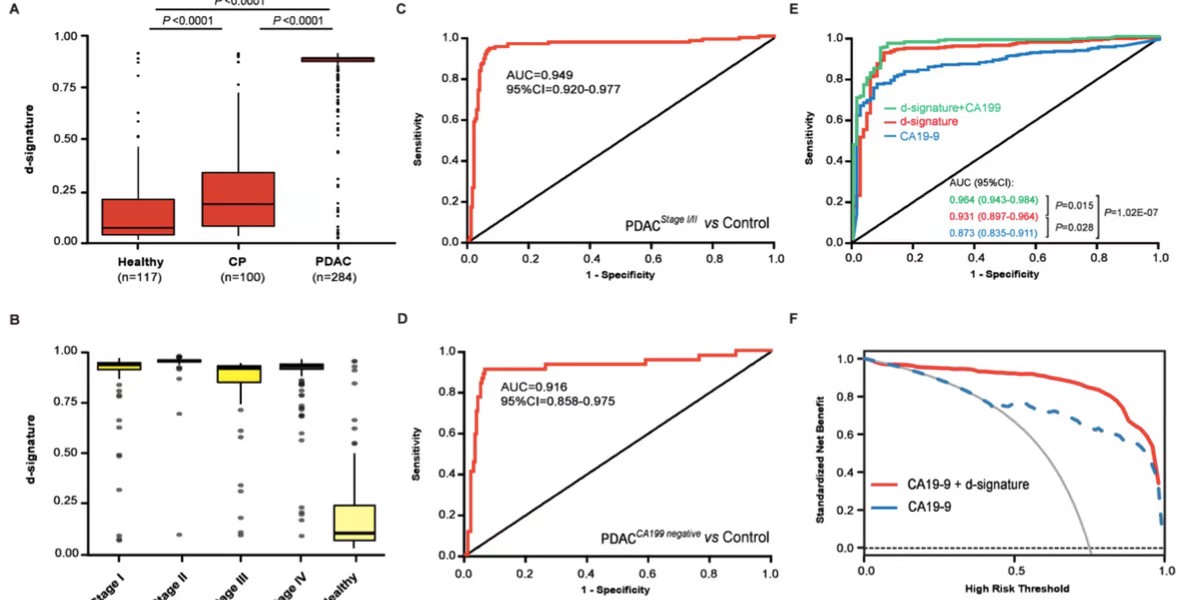
目前胰腺导管腺癌在可切除阶段仍难以诊断,于是作者进一步探究该模型是否具有识别可切除PDAC患者的潜能。首先exLR d-signature评分可以明显的将PDAC和CP(0.936 vs0.180; Mann-Whitney U test, p<0.001)以及健康人区分开(0.936vs 0.078; Mann-Whitney U test, p<0.001),其次作者证实了exLRd-signature评分与年龄、性别以及肿瘤负荷无关,因此极有可能诊断出早期负荷较小的可切除PDAC。作者接下来在不同分期肿瘤中对模型性能进行了验证,结果显示:在不同分期(stage I, II and III/IV)中鉴别PDAC和(CP+healthy)的AUC 为0.966,0.988 和 0.941。在不同分期(stage I, IIand III/IV)中鉴别PDAC和CP的AUC 为0.931, 0.966和0.915。在3个合并队列的可切除分期(stage I/II)中鉴别PDAC和对照 (CP+healthy)的AUC 为0.949 (95% CI: 0.920-0.977)。这些结果表明,exLR d-signature可用于PDAC的高精度的诊断。
CA19-9是目前临床上诊断PDAC的标志物,作者进一步探讨了d-signature在鉴别PDAC和健康者是否具有优于当前使用的CA19-9的性能(包括可以鉴别诊断出CA19-9阴性的PDAC和健康者)。结果显示,在3个混合队列中,d-signature可以区分开CA19-9阴性的PDAC和健康,AUC=0.916,95% CI: 0.858-0.975;sensitivity=90.91%,95% CI: 78.33%-97.47%;specificity=88.48%,95% CI: 83.46%-92.40%;accuracy=88.89%,95% CI: 88.43% -92.43%。进一步分析发现d-signature单独的诊断效能高于CA19-9单独的诊断效(p=0.028), 并且将d-signature结合CA19-9用于PDAC诊断时达到了更优的诊断效能 (AUC=0.964,95% CI: 0.943-0.984),并且决策曲线分析也证实了与 CA19-9 相比,exLR d-signature结合CA19-9 有更卓越的预测性能。以上的分析均证实了d-signature可以提高当前临床对PDAC的诊断效能。
原文:Yu S, Li Y, Liao Z, et al. Plasma extracellular vesicle long RNA profiling identifies a diagnostic signature for the detection of pancreatic ductal adenocarcinoma. Gut. 2019 Sep 27. pii: gutjnl-2019-318860.
- - - 推荐阅读 - - -

2019国自然超级增强子、RNA修饰、胞外囊泡项目解析
8月16日,翘首以盼的国家自然科学基金项目终于公布了。在医学与生物学相关研究领域中,表观遗传学现有的研究成果,是咱们华人科学家贡献比较多的一个领域。而从2019年国家自然科学基金中,我们也看到了许多令人兴
2019-08-30

Nature | 相分离调控转录起始至转录延伸的转换过程
本文转载自公众号BioArt 撰文|赤贞 责编|兮 近年来,“相分离”相关研究十分火热,自从TonyAHyman等人发现相分离现象之后,许多团队对相分离在复杂的生物学过程中所起到的重要
2019-08-21

Molecular Cell | 宋岳林等揭示超级增强子动态甲基化调控转录异质性
转载自公众号Bioart 责编|兮 CpGDNA甲基化早在70年代就被提出是一种用来控制基因表达的DNA化学修饰,而我们对DNA甲基化在基因组不同区域的具体功能,在疾病、发育过程中所扮演的具体角色,以及控制基
2019-08-16
