lncRNA研究策略—来自Science一作王品博士的经验分享
lncRNA资深研究者——王品博士,在刚过去的10月,以第一作者的身份在Science 杂志刊登了题为 “An Interferon-independent lncRNA promotesviral replication by modulating cellular metabolism” 的研究论文,且这是他在Science 杂志刊登的第二篇lncRNA研究成果了。表观生物公众号很荣幸邀请到了王博士为广大的 lncRNA研究者分享了他对非编码RNA的研究心得和策略,下面大家一起来学习交流吧:
非编码RNA主要的研究策略
王品
非编码RNA研究日趋深入,其种类繁多,作用机制多样,多年来一直是医学生命科学研究的热点和难点。目前,非编码RNA功能和机制研究上主要采用两个策略:1,以非编码RNA为对象入手;2,从某一个分子作用模式入手。
1. 以非编码RNA为对象入手。从不同刺激或处理的转录组或表达组入手,寻找差异表达的非编码RNA。通过差异倍数和显著性,及非编码RNA的基因组定位信息等筛选功能性候选RNA分子。然后通过后续干扰siRNA或Cas91,2进行功能筛选,锁定功能比较显著的RNA分子。最后进行RNA功能的分子机制研究,包括确定其相互作用分子,作用结合位点和作用的分子机制等。主要用到的技术有RNA-pulldown3,RIP4,ChIRP5等蛋白与RNA、DNA与RNA相互作用实验技术6。该策略是非编码RNA研究的常规套路,稳定可靠,风险性较小,而后期分子机制研究一般是课题进展的难点,比较适用于大规模临床样品的课题和独特实验模型的课题。
2. 从某一个分子作用模式入手。与第一种策略相反,该策略先靶向一个重要的蛋白分子7,可以是信号转导分子、酶类或者转录因子等,或者一个细胞亚结构,如线粒体、核内旁班8、外泌体等,通过RIP-seq9或者 RNA-seq 检测其结合的或者包含的RNA,按照富集的倍数和显著性筛选候选RNA分子,后面通过siRNA 或者高表达的方法筛选功能RNA10。该策略的优点是从课题设计开始就有明确指向的功能分子机制,在后续的分子机制研究中比较方便展开;而难点是前期如何做好RIP-seq 和细胞亚结构的有效分离,这是后续实验可靠性和可行性的重要保障。
两种策略在实验技术上有部分重叠,但也有各自独特的实验技术需求或数据分析策略。不同策略适应于不同的课题和实验室背景,在选择的时候可以根据课题特点和实验室技术体系进行取舍。当然,两种策略也可以同时应用,相得益彰,相互作证,起到更好验证效果,建议大课题采用。
接下来,Epi老师结合王品博士最近发表的lncRNA重要研究成果,来进一步理解王品博士总结的第一种研究策略:
1."从不同刺激或处理的转录组或表达组入手,寻找差异表达的非编码RNA”
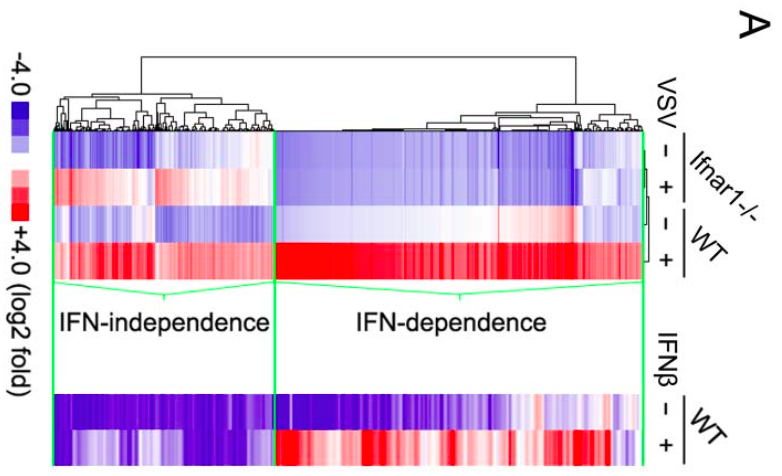
对VSV病毒处理过和未经病毒处理的IFN-I受体缺失和野生型巨噬细胞进行RNA-seq,鉴定得一批被病毒诱导表达,而不受IFN-I影响的lncRNA。
2."通过后续干扰siRNA或Cas9,进行功能筛选,锁定功能比较显著的RNA分子”

通过RNAi筛选,发现敲降lncRNA-ACOD1后,巨噬细胞中的病毒滴度显著下调
3."最后进行RNA功能的分子机制研究,包括确定其相互作用分子,作用结合位点和作用的分子机制等”
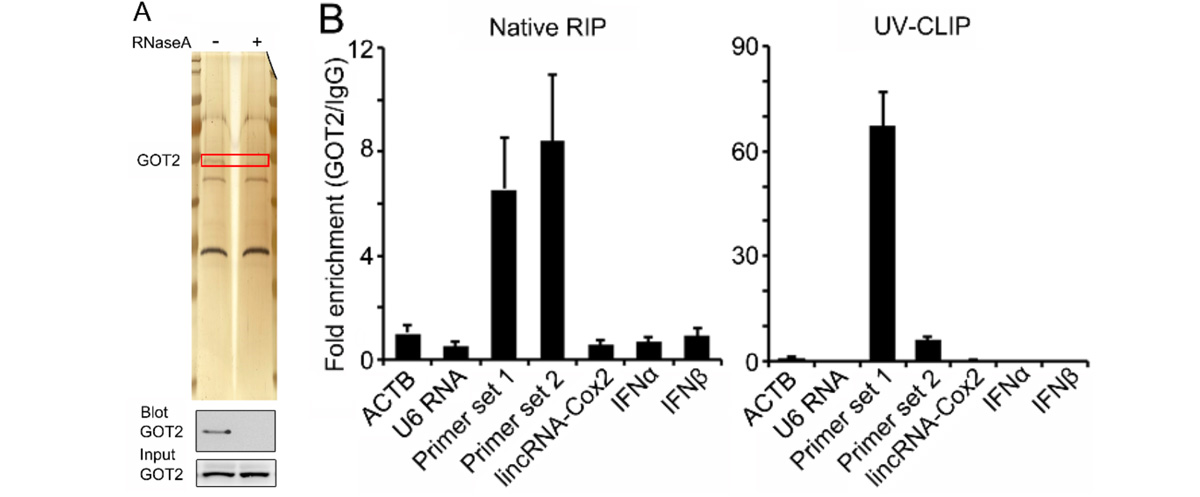
通过ChIRP-MS,研究者发现lncRNA-ACOD1可结合GOT2(谷草转氨酶2);RIP和CLIP进一步证实lncRNA-ACOD1高度富集于GOT2特异性抗体回收复合物。
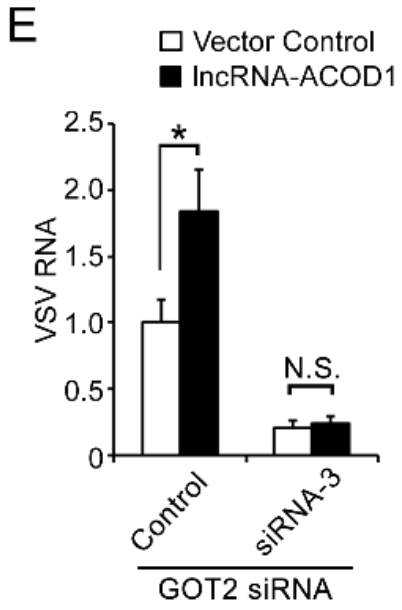
敲降GOT2,会减少VSV病毒复制;过表达lncRNA-ACOD1,会促进病毒复制;但在敲降GOT2的同时过表达lncRNA-ACOD1,并没有产生影响,研究者猜想是病毒诱导的lncRNA-ACOD1反馈,通过与GOT2结合,促进病毒复制。
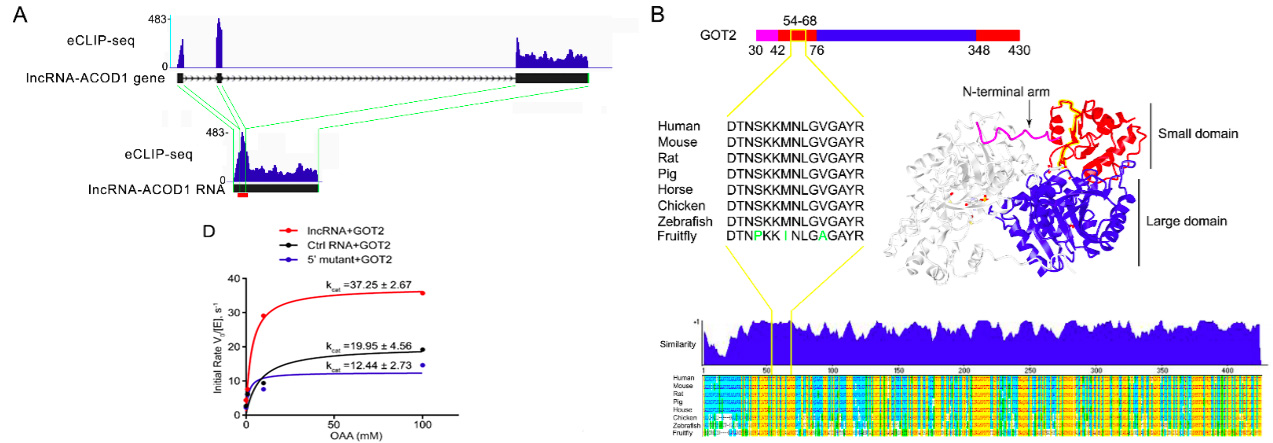
A-B:通过eCLIP和蛋白质谱技术,研究者发现lncRNA-ACOD1主要通过5’端第165~390个核酸序列与GOT2的第54~68个氨基酸结合,而这正是GOT2与底物结合的活性位点;D:HPLC-MS结果证明,lncRNA-ACOD1的存在可以显著提高的GOT2的催化活性。
综上所述,该研究发现了病毒利用宿主代谢调控网络来在宿主体内存活的一种新方法,揭示了代谢调控与病毒侵染之间的关系,对于与代谢异常和病毒相关的临床疾病,lncACOD1有望成为治疗干预的靶标。
Epi老师:结合了案例之后,对王品博士和我们分享的研究思路理解得是不是更加透彻了?对lncRNA机制研究有否信心大增?希望大家看完今天这篇推送,都能够有所获益。再次感谢王品博士的无私分享!最后,附上Epi老师总结的lncRNA研究路线,给需要的同学们。
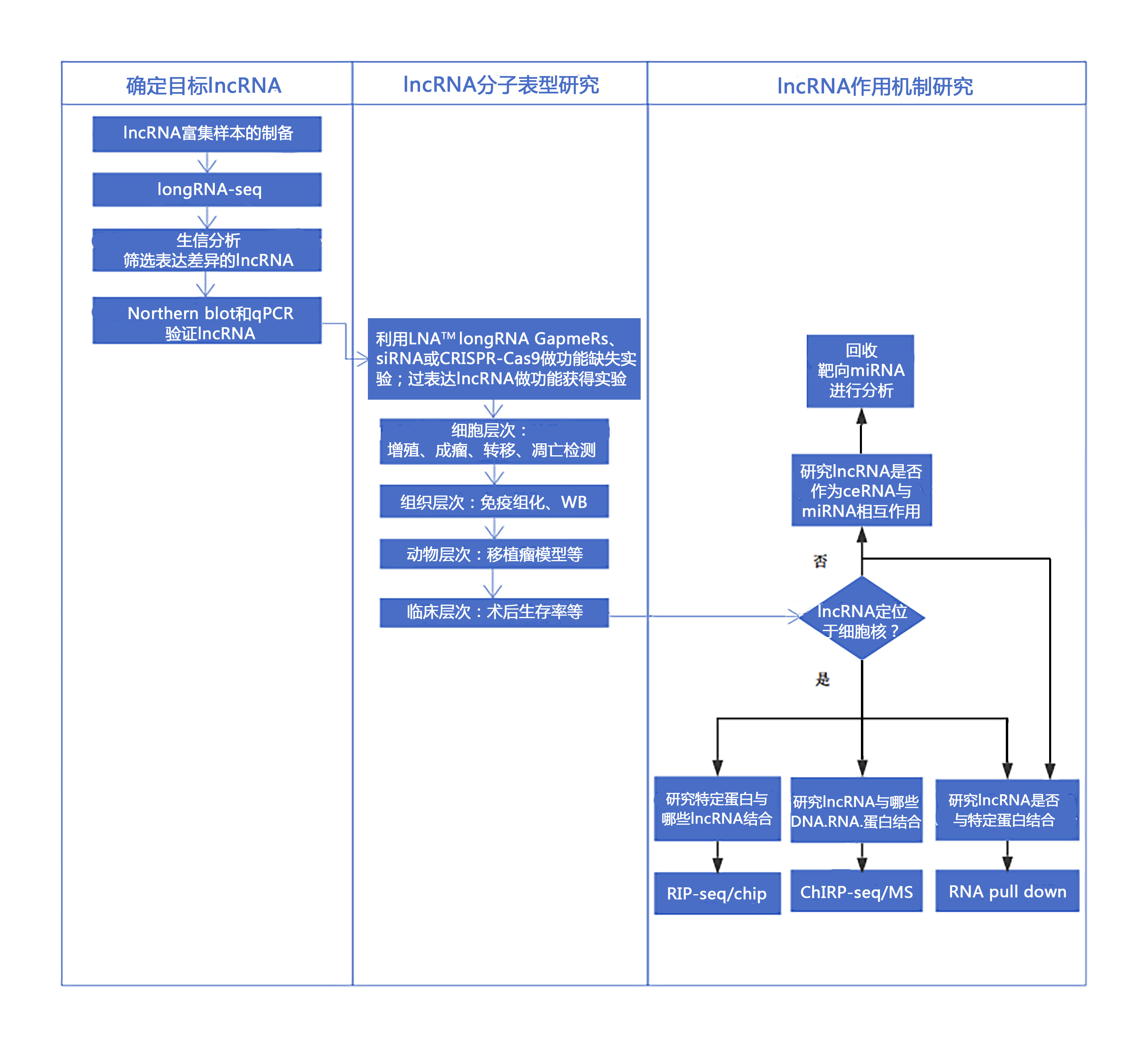
图出自表观生物《备战2018NSFC》
专题三:lncRNA功能及机制研究
王品个人简介
王品博士现为海军军医大学(第二军医大学)免疫学研究所暨医学免疫学国家重点实验室副教授,国家优青,也是中国工程院曹雪涛研究团队的成员,长期从事非编码基因功能学研究,致力于从高通量数据中筛选功能调控基因及其机制研究,以第一作者或通讯作者发表研究论文7篇,累计SCI他引超过1000次。
主要已发表文章:
1. P. Wang et al., An interferon-independent lncRNA promotes viralreplication by modulating cellular metabolism. Science 10.1126/science.aao0409(2017).
该研究发现lncRNA调控胞内代谢促进病毒感染新机制,阐述了干扰素非依赖的病毒感染调控新模式,即本文所引用的案例。
2. P. Wang et al.,The STAT3-Binding Long Noncoding RNA lnc-DCControls Human Dendritic Cell Differentiation. Science 344, 310 (2014).
该研究发现树突状细胞中特异性表达的功能调控分子lnc-DC,提出了lncRNA直接调控胞内信号转导的新模式
附:王博士研究策略提及的参考文献
1. Ran, F.A. et al. In vivo genome editingusing Staphylococcus aureus Cas9. Nature 520,186-191 (2015).
2. Ho, T.T. et al. Targeting non-coding RNAswith the CRISPR/Cas9 system in human cell lines. Nucleic acids research 43,e17(2015).
3. Atianand, M.K. et al. A Long NoncodingRNA lincRNA-EPS Acts as a Transcriptional Brake to Restrain Inflammation. Cell 165,1672-1685(2016).
4. Liu, B. et al. Long noncoding RNAlncKdm2b is required for ILC3 maintenance by initiation of Zfp292 expression. Natureimmunology 18,499-508 (2017).
5. Chu, C., Quinn, J. & Chang, H.Y.Chromatin isolation by RNA purification (ChIRP). Journal of visualizedexperiments : JoVE (2012).
6. Wang, P. et al. The STAT3-binding longnoncoding RNA lnc-DC controls human dendritic cell differentiation. Science 344,310-313(2014).
7. Liepelt, A. et al. Identification ofRNA-binding Proteins in Macrophages by Interactome Capture. Mol Cell Proteomics15,2699-2714 (2016).
8. Adriaens, C. et al. p53 induces formationof NEAT1 lncRNA-containing paraspeckles that modulate replication stressresponse and chemosensitivity. Nat Med (2016).
9. Van Nostrand, E.L. et al. Robusttranscriptome-wide discovery of RNA-binding protein binding sites with enhancedCLIP (eCLIP). Nature methods 13,508-514 (2016).
10. Xing, Y.H. et al. SLERT Regulates DDX21Rings Associated with Pol I Transcription. Cell 169,664-678 e616 (2017).
- - - 推荐阅读 - - -
这篇 Cell 文章告诉你如何研究外泌体 miRNA
研究外泌体miRNA的文章越来越多,可是高分的并不多。怎么样的外泌体实验结果在审稿人眼中才具有说服力?Epi老师今天带你们看看这篇最近发表于Cell的外泌体miRNA文章。 肥胖引起的慢性组织炎症是胰岛
2017-11-02

Mol Cell: Spt6利用超级增强子维持细胞多能性
延长因子Spt6如何利用超级增强子、多梳蛋白使ESC细胞保有多能性?10月19日,Mol Cell上发表的一篇来自NIH研究者的文章解答了这个问题。
2017-10-30

RNA表观遗传学开创者何川: 总想着赚钱太急功近利
何川,RNA表观遗传学开创者。早年毕业于中国科技大学,2000年获麻省理工学院博士学位,2000到2002年在哈佛大学做博士后研究,2002年至今执教芝加哥大学化学系, 是芝加哥大学生物物理动态研究所主任, 北京大学合成与功能生物分子中心主任. 何川,RNA表观遗传学开创者。早年毕业于中国科技大学,2000年获麻省理工学院博士学位,2000到2002年在哈佛大学做博士后研究,2002年至今执教芝加哥大学化学系,是芝加哥大学生物物理动态研究所主任,
2017-10-10
