Epiview深度解读 | Science : circRNA在大脑中的潜在功能!
当 RNA 咬住了自己的尾巴,变身环形 RNA(circular RNA,以下简称 circRNA)之后,会有怎样特殊的功能呢?跟随小编的步伐,简单回顾 circRNA 的研究历程,接着深入剖析 8 月 10 日在 Science 上 online 的一篇关于 circRNA 的文章,了解 circRNA 的功能和研究范式,最后对今后可能的方向进行展望。

这篇 Science 首先在小鼠和人脑组织切片中验证了 miR-7 和 miR-671 可按照不同的方式结合 circRNA Cdr1as,接着通过 CRISPR/Cas9 技术敲除 Cdr1as 的一个基因座制造杂合突变小鼠,选取 4 个脑区进行分析,发现 miR-7 显著下调,miR-671 显著上调,此外 miR-7 的靶基因显著上调;这些基因表达异常可影响兴奋性突触传递过程,进而导致小鼠前脉冲抑制(PPI)障碍。PPI 在精神分裂症等多种神经精神性疾病中丧失,提示 circRNA Cdr1as 在这些疾病中的潜在功能。
如果 RNA 也像蛇一样咬住自己的尾巴
1864 年,德国青年化学家凯库勒研究苯环的结构已经三年,依然没有突破。寒冬中的一天晚上,凯库勒坐在桌前写教科书,写的有些累了,他把椅子转向炉火,打起瞌睡。在梦中,原子在凯库勒眼前跳跃,大的、小的、成串的。突然成串的原子旋转起来,像蛇一样咬住自己的尾巴!看!有一条蛇咬住了自己的尾巴,这个形状在眼前旋转不停。电光一闪,凯库勒从梦中惊醒。苯的结构为什么不能是环状的呢!1865 年,凯库勒发表了苯的六元环结构,这是有机化学中里程碑式的发现。
图 1. 凯库勒美妙的梦揭开了有机化学的新篇章
中心法则中,遗传信息从 DNA 流向 RNA,接着流向蛋白质。RNA 似乎只是一个遗传信息的“快递员”,但越来越多的研究发现 RNA 的功能异常丰富,远不止“快递员”这么简单,尤其是大量非编码 RNA(noncodingRNA, ncRNA)。但我们所熟知的 ncRNA,比如 miRNA、siRNA、lncRNA、piRNA 等,在印象中都是线性的。是否也存在可以咬住自己尾巴的环形 RNA 呢?
确实存在,而且存在了很多年。早在 1976 年的时候,科学家们就已经发现了 CircRNA,但当时误以为是类病毒;1979 年,才搞清楚这是内源性 RNA 剪接的产物;此后的几十年,人们一直认为 CircRNA 是可变剪接出错的结果,没有给予太多重视。直到近 5 年,CircRNA 才逐渐火热起来!
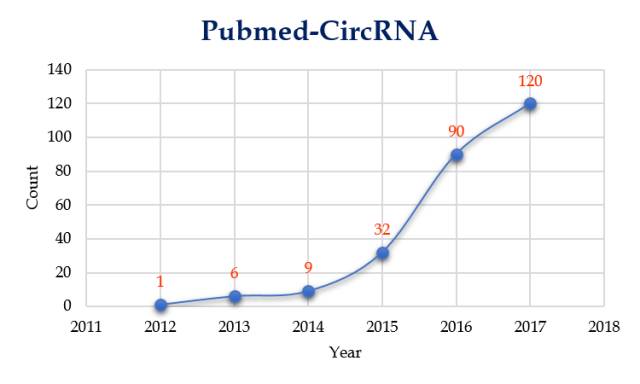
图 2. 以 CircRNA 为关键词在 Pubmed 中搜索的结果
(1976 年和 79 年的文章中用的都是 circular RNA,不是 circRNA,因此没有出现在统计中,数据统计日期为 2017 年 8 月 14 日)
仔细扒一扒 CircRNA 发展历程中的关键成果,发现 2012 年的一篇文章《Transcriptome-wide discovery of circular RNAs in Archaea》可谓“星星之火”,文章借助高通量测序技术,对古细菌中的 CircRNA 进行了全基因组范围的探究。
2013 年出现了六篇重要文章。其中包括三月份的两篇重量级 Nature 文章:Memczak 等揭示了 CircRNA 具有调控潜能;而 Hansen 等直接给出答案,CircRNA 可以作为 miRNA 海绵。随后的几个月,有文章系统性地分析了 CircRNA 在阿尔兹海默症以及癌症中的关键功能,这让 CircRNA 大显神通!很快有团队建立了 CircRNA 与疾病相关的数据库 Circ2Traits。之后 CircRNA 的研究呈指数增长,目前还在飞速发展中。

图 3. CircRNA 研究历程中关键的文章
值得一提的是,中科院上海计算生物所的杨力研究员和生化细胞所的陈玲玲研究员(还是令人羡慕的夫妻)对 CircRNA 领域贡献颇丰。2014 年,杨力和陈玲玲老师开发了 CIRCexplorer,在人源胚胎干细胞 H9 中发现近万条 circRNA,首次证明了内含子 RNA 互补序列介导的外显子环化。近几年,陈玲玲老师和杨力老师持续发力,贡献了诸多重要的成果。
目前通常认为,CircRNA 是一类单链的环形 RNA,由 pre-mRNA 反向剪接(back-splicing)形成,通常含有 1~5 个外显子,可归入长链非编码 RNA 之列。CircRNA 的功能主要包括:(1) 可作为 miRNA 海绵,即一个 CircRNA 上具有很多个 miRNA 结合位点;(2) 可调控转录过程;(3) CircRNA 合成过程可影响可变剪接。此外,有研究报道 CricRNA 可影响 mRNA 的稳定性,甚至可翻译为蛋白发挥功能。
Cdr1as:在哺乳动物神经元中特异性表达
miRNA 可靶向与其互补的 mRNA,并在 Ago2 蛋白的作用下,对 mRNA 进行剪切。Ago2 介导的 mRNA 沉默过程会产生 miRNA-target RNA-Ago2 的嵌合体。通过 CLIP-Seq 技术,在小鼠和人类死亡的大脑中鉴定了上万个嵌合体。对 miR-7 嵌合体中的靶序列进行分析和排序,发现无论是在人类还是小鼠大脑中,排在第一位的都是 Cdr1as。

图 4. 在小鼠和人类脑组织中 miR-7 和 miR-671 可结合 Cdr1as
能与 Cdr1as 结合的还有 miR-671。但 miR-7 和 miR-671 跟 Cdr1as 的结合方式差异很大:首先,Cdr1as 有 70 个 miR-7 结合位点,而只有一个很强的 miR-671 结合位点;此外,miR-7 只有 5’-端的部分序列(seed,即种子序列)与 Cdr1as 互补配对,但 miR-671 几乎可以完美地与 Cdr1as 配对。这种结合方式的不同导致 miR-7 引导的 Ago2 蛋白不能对 Cdr1as 实现有效剪切,而 miR-671 却可以;miR-7 和 miR-671 结合 Cdr1as 的方式在物种中保守,提示这种特异性的结合方式可以具有关键的功能。
现在通常认为 Cdr1as 是 miR-7 的海绵,而 miR-671 介导的 Cdr1as 的降解可释放与 Cdr1as 结合的 miR-7。打一个比方,Cdr1as 就是一个带锁的小盒子,miR-7 和 miR-671 都是钥匙,Cdr1as 小盒子中可以存放 70 把 miR-7 的小钥匙,而只需要一把 miR-671 的钥匙,就可以打开 Cdr1as 这个盒子,进而释放 70 把钥匙,这 70 把钥匙又可以去打开其他过程的盒子。
值得注意的是,小鼠大脑中的嵌合体数据分析显示,与 miR-7 结合的 RNA 中排在第二位的是 lncRNA Cyrano。Cyrano 中包含一个几乎可以完美地与 miR-7 的结合位点,并且该位点高度保守,这也提示 lncRNA Cyrano 在中枢神经系统中对 miR-7 具有重要的调控作用。
那么 Cdr1as 在大脑中的表达模式是怎样的呢?这里用到了 RNA-FISH(荧光原位杂交),对不同的神经细胞用不同的荧光标签进行区分,发现在皮质切片中 Cdr1as 只在神经元中高表达,而且主要集中在兴奋性神经元中;而在神经胶质细胞(少突胶质细胞和星形胶质细胞)中不表达。
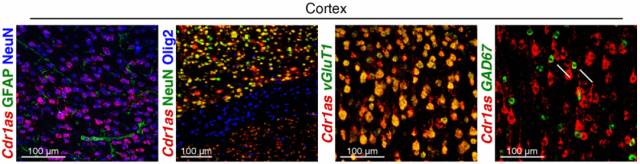
图 5. Cdr1as 在兴奋性神经元中高表达
(分子标签:NeuN-neurons, GFAP - astrocytes, Olig2 – oligodendrocytes, vGluT1 - excitatory neurons, GAD67 - inhibitoryneurons,每种神经元颜色见上图中字体颜色)
在不同的脑区中,比如前额皮质、海马、中脑和后脑,表达 Cdr1as 的绝大多数神经元都是 vGluT1 和 vGluT2 阳性的;在小脑中,Cdr1as 也只在含有大量兴奋性神经元的颗粒层中表达,而不在分子层中的 GABA能神经元(GABAergic neurons)和浦肯野细胞中表达。
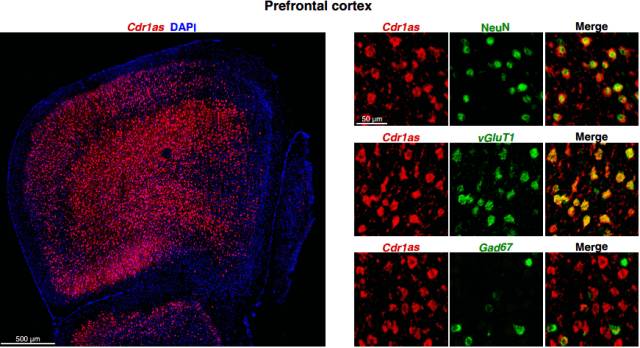
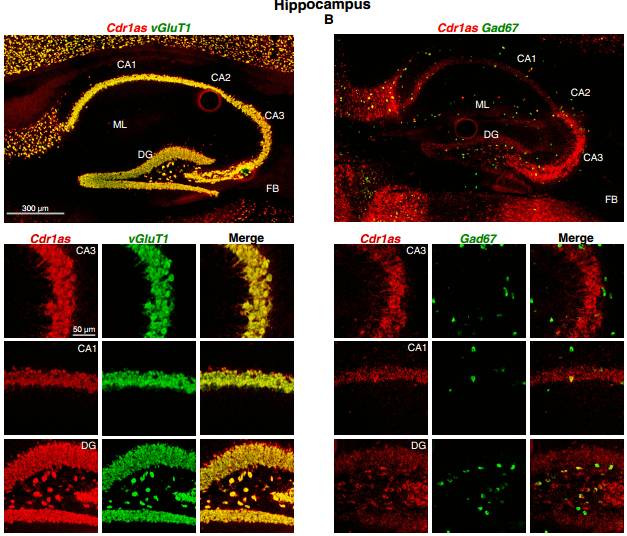
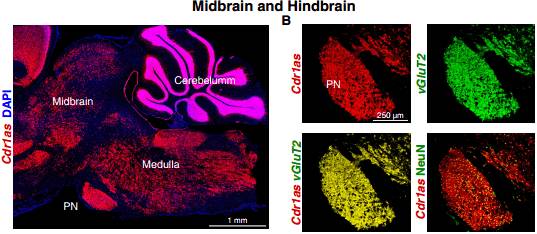

图 6. 在不同脑区中 Cdr1s 的表达情况
进一步利用单分子 RNA FISH,在原代皮层神经元中发现 Cdr1as 不仅出现在神经元胞体中,还出现在突起(neurites)中,这说明在不同的亚细胞定位中,Cdr1as 都会有潜在的生物功能。
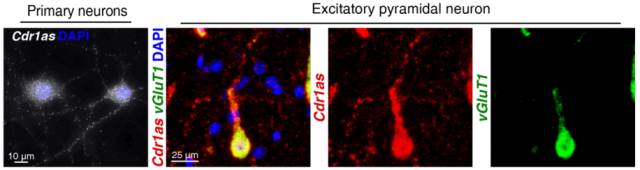
图 7. Cdr1as 可同时在胞体和突起中表达
基因编辑小鼠揭示 Cdr1as 功能
如何研究一个 CircRNA 的功能呢?在人类和小鼠大脑中,Cdr1as 可有效地环化,检测不到线性的转录本。CircRNA 非常稳定,半衰期很长,在转录水平上实现沉默有一定难度。最直接的策略是用 CRISPR/Ca9 敲除 Cdr1as 的基因座,制造功能缺失的小鼠模型。
但这种策略可能会影响另一条链的转录,让情况变得更加复杂。为了评估另一条链的表达情况,作者利用可以与 Cdr1 mRNA 互补的探针对小鼠的 4 个脑区进行检测,进行原位杂交实验,分析已经发表的 RNA-seq、CAGE 和染色质修饰数据。在小鼠的大脑、特定的脑区或者其他小鼠和人类组织中,都没有检测到 Cdr1as 反向互补链的转录。这说明用 CRISPR/Ca9 敲除 Cdr1as 的基因座是可行的。
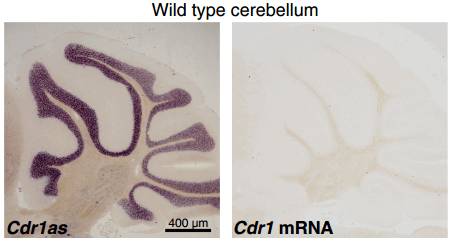
图 8. 在小鼠小脑中可以检测到 Cdr1as,但检测不到 Cdr1mRNA
利用 CRISPR/Cas9 敲除 Cdr1as 基因座,并分别通过基因型、原位杂交、Northern blot 和 qRT-PCR 验证。
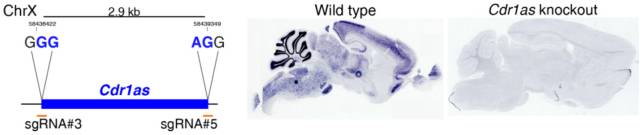
图 9. 验证 KO 小鼠
Cdr1as 位于 X 染色体上,因此在分析敲除的小鼠之前,需要先搞清楚在野生型(WT)雄性和雌性、以及杂合子雌性小鼠大脑中 Cdr1as 的表达情况。qRT-PCR 实验结果显示, Cdr1as 在野生型雄性和雌性小鼠中几乎一样,而杂合子雌性小鼠中 Cdr1as 的水平降低到 WT 的一半。
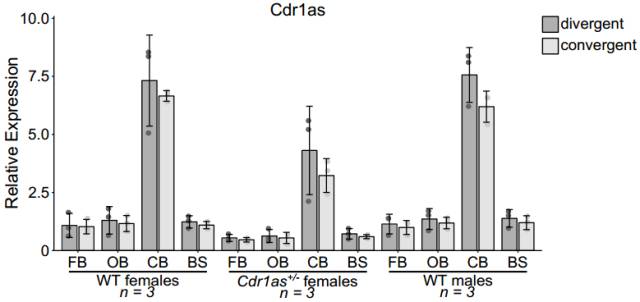
图 10. Cdr1as 在 WT 雄性和雌性以及杂合子中的表达
FB -forebrain(前脑), OB - olfactory bulb(嗅球), CB – cerebellum(小脑), BS – brainstem(脑干).
鉴于 WT 小鼠中,Cdr1as 表达与性别无关。后续的实验选用杂合子雄鼠做实验。
miR-1 和 miR-671 的转录后调控
之前在细胞系中,已经发现 miR-1 和 miR-671 可结合到 Cdr1as。但是在脑中是否也是这样呢?本文选取了高表达 Cdr1as 的小脑、皮质、海马和嗅球等 4 个主要脑区进行 miRNA seq。比较 WT 和 KO 小鼠 4 个脑区中的 miRNAseq 数据,并结合 Northern blot,发现 miR-7 在 KO 小鼠中显著下调。更加具体的情况是,miR-7a-5p 和 miR-7b-5p(它们的种子序列相同,成熟的 RNA 序列略有差别)在所有的脑区中均下调。
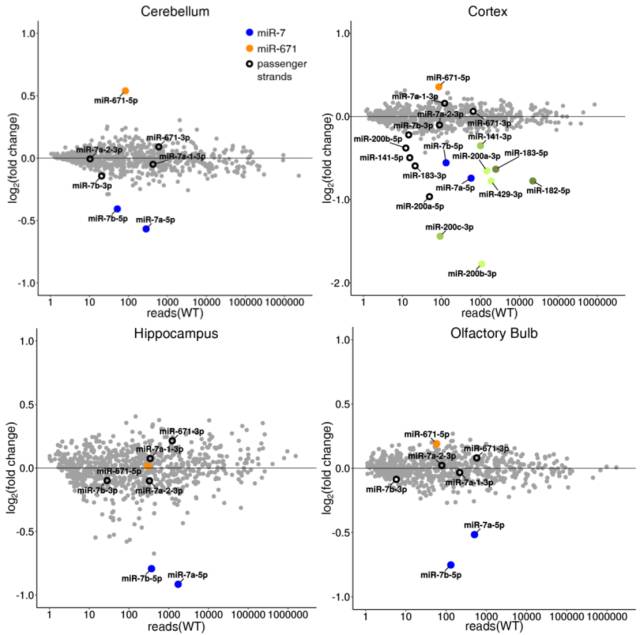
图 11. Cdr1as 敲除后在小鼠各脑区中差异性表达的 miRNA
miR-7 的表达下调具有高度特异性。在鉴定到的上百个 miRNAs 中,除了 miR-7a-5p 和 miR-7b-5p,另外只有 8 个 miRNA 显著下调,而且这只出现在皮质中。所有的这些 miRNA 属于两个家族,来源于三个原始转录本(miR-200c/141、miR-200a/200b/429、miR-182/183/96)。
miR-7 的表达下调是转录后(post-transcriptional)的。区分转录后和共转录(co-transcriptional)过程是分子生物学非常重要和本质的问题。测序结果显示,miR-7 的全部的三种中间链(passenger strands,分别为 miR-7a-1-3p、miR-7a-2-3p、miR-7b-3p)并没有显著下调(在上图中并不显著)。通过 Northern blot 和 pre-miR-7a-1 的 qRT-PCR 进行验证。另外,皮质中 miR-200 和 miR-183 家族来源的 miRNA 表达下调,可能是由于其中间链本身就下调了。
与 miR-7 相反,在 KO 动物的小脑、皮质和嗅球中,miR-671-5p 表达上调。跟 miR-7 类似,KO 小鼠中这种上调也是高度特异性的,而且除了 miR-671,没有发现其他显著上调的 miRNA。此外,miR-671-5p 的表达上调也是转录后的。在 KO 小鼠和野生型小鼠提取出的 RNA 中用 Northern blot 检测,虽然 miR-671-3p 可以检测到而且没有发生改变,但却没有检测到成熟的 miR-671-5p。为何 miR-671-5p 及其前体 RNA 这么难检测到呢?一是成熟的 miR-671 表达量很低,而且在实验中不稳定;二是前体 RNA 加工自 Chpf2 转录本的编码序列中。
此外,在非脑组织中分析 Cdr1as、miR-7、miR-671 的表达,包括肺、骨骼肌、脾脏、心脏、脊髓。在脾脏中,Cdr1as 检测不到,但是 miR-7a 稳定表达,其他组织显示出非常低的 Cdr1as 表达量,而 miR-7a 的表达在 Cdr1as 去除后并没有改变。miR-7 表达唯一发生改变的非脑组织是脊髓,这也是唯一可以检测到 Cdr1as 表达的非脑组织。
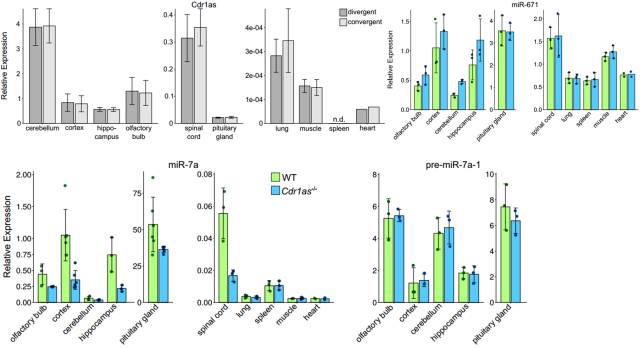
图 12. 在非脑组织中检测 Cdr1as、miR-1、miR-671 的表达
这些数据说明,在非脑组织中 Cdr1as 的缺失并不影响 miR-1 和 miR-671 的表达;而在神经组织中,miR-7 的下调则依赖于 Cdr1as 的缺失。
潜在媒介浮出水面:即早基因(immediate early genes)
何为即早基因(immediate early genes)呢?维基百科的解释是:Immediate early genes (IEGs) are genes which are activated transiently and rapidly in response to a wide variety of cellular stimuli.
miRNA 通过调控其靶基因进而影响个体的表型,这应该说是比较常规的套路了。在上面 4 个脑区中检测 miRNA 的同时做 mRNA-seq。在皮质、小脑和嗅球中,一些保守的 miR-7 靶基因显著上调,包括Fos、Nr4a3、Irs2、Klf4。此外,可与 miR-7 相互作用的lncRNA Cyrano 在 KO 小鼠的 4 个脑区中都高表达。
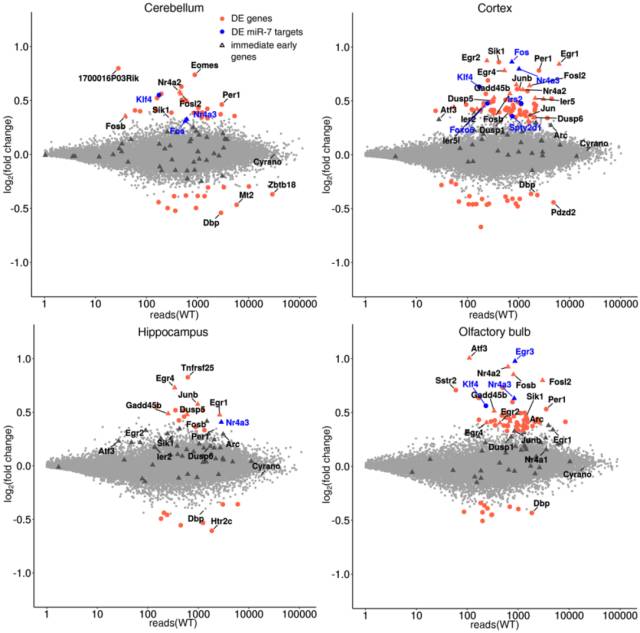
图 13. 在 Cdr1as 敲除后小鼠 4 个脑区中差异表达的基因
进一步对这些上调的基因进行审查,发现了一些显著的IEGs,比如 Fos、Arc、Egr1、Egr2、Nr4a3 等。用同一只动物和另外的动物中的皮质和海马,通过 qRT-PCR 和 Nanostring 进行验证,确认了所有的候选基因中,即早基因的蛋白表达水平升高。其中 c-Fos、Egr1、Arc 等通过 Western Blot 检测,进一步通过免疫组织化学验证 c-Fos 和 Egr1 在大脑切片中的表达。在四个脑区中对 c-Fos 的免疫组化结构进行定量,发现在 KO 小鼠中,表达 c-Fos 的神经元的数量增多,而且 c-Fos 信号强度更强。
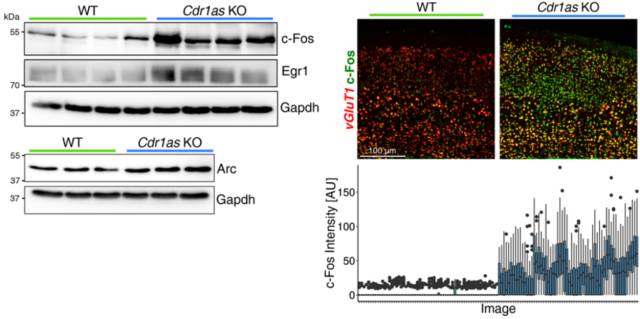
图 14. 对 IEGs 等多重验证
miR-7 是细胞周期和 IEGs(比如 Fos)的抑制因子,提示了 Cdr1as 的去除与 IEGs 表达上调间的联系;第二,此前研究表明,IEGs 的表达上调与神经元的活性增加密切相关,因此暗示了 Cdr1as 导致的 IEGs 的上调可能会影响动物的行为。
在 KO 小鼠的非脑组织中,IEGs 的表达水平没有改变,说明 IEGs 表达上调是大脑依赖的,而且与 Cdr1as 的水平密切相关。除了 IEGs,在 KO 小鼠大脑中,还发现了一些差异表达的生物钟基因,比如 Per1 和 Sik1相应地上调,而 Dbp 相应地下调。此前研究发现,在前脑中,这种表达的模式与睡眠剥夺与持续性觉醒相关。
Cdr1as 与兴奋性突触传递失调
Cdr1as 缺失后,在突触水平到底会产生什么生理学结果呢?利用单海马神经元研究兴奋性突触后电流(excitatory post synaptic currents,EPSCs)。结果发现,在 KO 小鼠的神经元中,自发性的囊泡释放显著上调,微小兴奋性突触后电流频率(而不是振幅)加倍。通过分析钙离子诱发的突触反应,发现 KO 与 WT 小鼠神经元相比,兴奋性突触后电流的振幅并没有显著不同。
虽然计算得到的囊泡释放概论没有发生显著改变,但是 KO 小鼠对两个连续刺激的响应,以及对 10Hz 的动作电位序列的响应与 WT 小鼠显著不同。
这些结果反应了在 KO 小鼠神经元正在进行的突触释放活动中囊泡置换活性发生改变,以及在突触响应中显示出更强的抑制作用。总的来说,Cdr1as 的缺乏可导致兴奋性突触传递的失调,潜在的机制包括突触蛋白表达的变化、突触特化异常、突触钙稳态的改变。
小鼠行为上有什么具体体现呢?分别对 WT 小鼠和 KO 小鼠进行行为学实验。KO 小鼠的社会活动、焦虑水平、不受干扰的自发活动、在认知记忆或探索行为方面都没有显著的缺陷,但是唯独惊吓反应测试中,在三个不同的前脉冲强度下,前脉冲抑制(prepulse inhibition,PPI)显示出很强的差异。
PPI 指惊吓反射中在惊吓刺激(脉冲)之前给予轻微刺激(前脉冲)可以抑制动物对刺激反应的现象。PPI 是感觉运动门控水平的标志之一。精神分裂症患者感觉运动门控丧失,从而导致信息超载出现幻觉和妄想症状,同时伴有 PPI 的降低,PPI 是认知障碍的可测量的指标之一。(本段解释来自于《认知障碍的前脉冲抑制模型》)
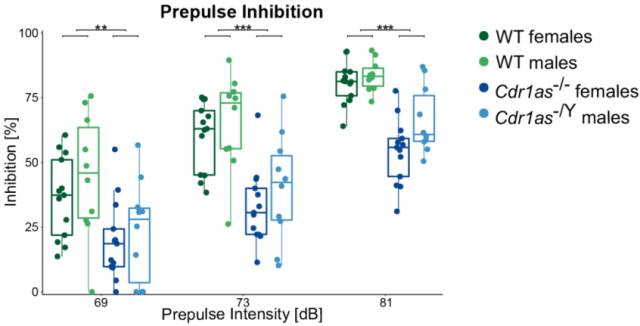
图 15. Cdr1as 的敲除显著影响小鼠的 PPI
总的来说,Cdr1as 的敲除显示出与神经精神疾病相关的表型,比如 PPI 受损,而且IEGs 很有可能参与其中。这些结果为今后的研究提供了很好的参考价值,也提供了很多可供挖掘的线索。
讨论:
1. 为何这篇文章可以发在Science?
第一,这篇文章建立了 CircRNA 与神经精神性疾病间的联系;第二,本文做的是热点领域 CircRNA,而且阐明了一种特定的 CircRNA Cdr1as 在哺乳动物脑中的功能;第三,本文提供了很多后续研究的线索;第四,本文内容详实,大量的炫酷的荧光图应该也是一个加分项。
2. 本文用到了 CRISPR/Cas9 技术,其脱靶效应如何解决?
文章也提到了这一点,但是作者无法排除这一点。
3. 文章到底提供了哪些可以后续研究的线索?
(1) 文章附表中给出了与 miR-7 结合排在前 10 的 RNA,本文研究的只是排在第一的Cdr1as,而且提到了排在第二的 lncRNA Cyrano 也可能具有很重要的作用,因此 Cyrano 到底在哺乳动物大脑中发挥什么功能呢?这绝对是非常有潜力的一个点。
(2) KO 小鼠中,一批 IEGs 上调,这些 IEGs 上调与小鼠的 PPI 抑制表型之间到底有什么关系?哪几个 IEGs 起到关键作用?具体的通路又是怎样的?
(3) KO小鼠大脑中,miR-7 表达下调后,不仅仅是 IEGs 受到影响,还有很多非 IEGs 的基因也差异性表达,那么这些基因的差异性表达又会产生哪些影响呢?
(4) miR-7、miR-671、miR-200 家族等都与肿瘤密切相关,Cdr1as 如何通过这些 miRNA 介导肿瘤的发生发展,这也是一个具有前景的方向。
通讯作者:从物理学家到生物学家
本文通讯作者为柏林医学系统生物学研究所的 Nikolaus Rajewsky。

图 16. 本文通讯作者 Nikolaus Rajewsky
Nikolaus Rajewsky 于 1997 年获得德国科隆大学(University of Cologne)理论物理博士学位,随后在美国罗格斯大学(Rutgers University)从事计算物理学博士后研究,第二轮博后他去了洛克菲勒大学的物理与生物学研究中心;2003 年获得纽约大学教职,任生物学和数学助理教授。2006 年,他回到德国,出任马克斯 • 德尔布吕克研究中心(Max Delbrück Center)生物信息学研究的带头人。
2006 年他回国的时候,Nature 还做过特别的报道,副标题就是 Physicist-turned-bioinformatician heads back to Germany。2008 年,他成为柏林医学系统生物学研究所的学术所长。
对于这种超高难度的跨界,Nikolaus Rajewsky 的态度是:What field of science you belong to depends on what questions you're asking。
再提一下 Nikolaus Rajewsky 所在的马克斯 • 德尔布吕克研究中心(Max Delbrück Center),以马克斯 • 德尔布吕克命名的。马克斯 • 德尔布吕克(Max Delbrück)是一位德裔美籍生物物理学家,1969 年因为噬菌体方面的杰出研究与阿尔弗雷德 • 德 • 赫希(Alfred Day Hershey)以及萨尔瓦多 • 爱德华 • 鲁利亚(Salvador Edward Luria)共同获得诺贝尔生理学或医学奖。
特别说明:第一段中关于凯库勒的故事有想象成分,此外凯库勒在苯的六元环发现过程中的贡献还有争议。
--- The End ---
本文转载自微信公众号【Epigenetics表观遗传学】
- - - 推荐阅读 - - -

NSFC| 你所关心的国自然中标项目分析: 外泌体.非编码RNA.增强子...
国家自然科学基金榜单公布了,这是让整个中国科研圈都沸腾的事情。Epi老师整理了一些前沿研究领域的中标项目数据,以下有你关心的研究方向吗? 表一NSFC中标项目数排名前20的依托单位
2017-08-22

Enhancer案例| Cell: 胰腺癌将增强子重编程,促进肿瘤转移
众所周知,肿瘤的发生,具有遗传因素。那么,肿瘤的转移呢?与遗传相关与否?所幸的是,今天我们有了更多的研究工具,还知道除了基因序列能遗传,基因其他方面的变化,也会遗传和影响下一代的基因,那就是表观遗传.
2017-08-21

今日起可查国自然基金申请结果,附最快的查询链接
关于公布2017年度国家自然科学基金申请项目评审结果的通告 国科金发计〔2017〕98号 2017年3月1日至3月20日项目申请集中接收期间,国家自然科学基金委员会(以下简称自然科学基金委)共接收项目
2017-08-17
