【推荐】RNA甲基化修饰(m6A)研究技术及方案设计
RNA 甲基化是表观遗传学内容的重要内容之一, 其中m6A(N6-methyladenosine,6-甲基腺嘌呤,化学结构见图1)较为常见的一种修饰方式。m6A是一种动态可逆的修饰方式,在转录后调控中发挥作用,其在调控基因表达、剪接、RNA 编辑、RNA 稳定性、控制mRNA寿命和降解、介导环状RNA翻译[1]等方面扮演重要角色,具有重要的研究意义(见图1)。
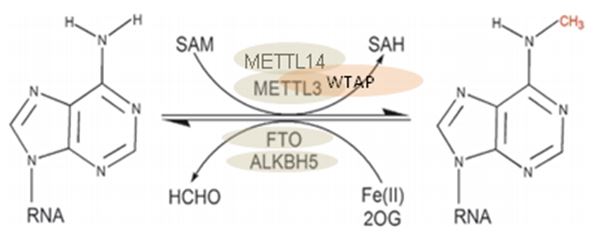
图1. 6-甲基腺嘌呤化学结构及可逆反应过程

图2.动态修饰的m6A修饰及介导的生物学功能[2]
m6A 甲基化修饰是由一个多蛋白复合物介导产生,目前已知这个复合物的成分包括METTL3,METTL14 和 WTAP;而负责擦除甲基化修饰基团的则由去甲基化酶 FTO 和 ALKBH5 所承担。在细胞核中的 HNRNPC 负责识别m6A修饰基团,并介导mRNA前体的选择性剪接。而另外一个m6A识别蛋白 HNRNPA2B1[3] 则促进 pri-miRNA 加工成 pre-miRNA。在细胞质中,不同的 m6A 位点识别蛋白介导不同的功能。YTHDF1 和YTHDF3[4,5]识别 m6A 修饰 mRNA,通过与起始因子及核糖体相互作用促进蛋白质翻译,eIF3识别蛋白也会直接绑定到 mRNA 5’UTR 端的 m6A位点参与翻译起始。而另外一个识别蛋白 YTHDF2 与 m6A 识别将导致 mRNA 的降解。目前还存在其他未知的 m6A 识别蛋白,相关研究的继续开展将有利于解开 m6A 在 mRNA 运输、翻译和存储等功能的谜团。
虽然 RNA 甲基化的研究在上世纪七十年代就开始,但是由于技术上的局限一直停滞不前,直到最近几年在何川教授等团队的带领下,通过不断的技术创新和难点攻克,m6A 等甲基化修饰的研究才不断取得突破性的研究成果。
关于 m6A 的研究方向,主要涉及 m6A 本身的修饰过程涉及的甲基化酶和去甲基化酶,以及m6A识别蛋白。这个研究方向的研究技术难度较大,涉及较多生化实验,慎入为好。其次是m6A修饰谱构建及作用机制,特别是构建疾病细胞模型或者发病组织的 m6A 修饰谱,涉及较为关键的 meRIP-seq (Methylated RNA Immunoprecipitation Sequencing)高通量测序技术[6]。第三个方向是 m6A 修饰失衡介导相关基因异常(可变剪切、稳定性、翻译、miRNA 调控)在所发挥的作用。第四个方向是通过大数据分析,利用公共数据资源对 m6A 修饰涉及的基因进行表达量统计,并进行共表达分析预测其可能调控的靶基因,进而进行功能验证。(见图3)
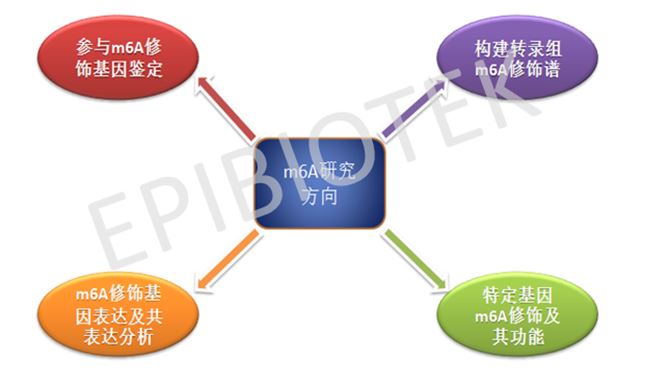
图3. m6A 的主要研究方向
下面我们将重点介绍其中一种研究方向的设计思路,并提供相应的技术服务和解决方案。
研究方向:构建转录组m6A修饰图谱
研究目的:构建目标样本的 m6A 修饰谱,揭示在特定生命过程或者疾病模型中的m6A图谱。
实验样本:细胞、组织、提取后的总 RNA(限定有参基因组物种)
关键技术:meRIP-seq (methylated RNA immunoprecipitation sequencing),也称 m6A-seq
最近几年来 m6A 研究迅速发展,正是得益于 meRIP-seq 技术的开发及应用。meRIP-seq 高通量测序技术的出现,能够高效精确检测全转录组不同的 RNA 甲基化,是成功发现 RNA 甲基化机理及功能的关键技术。
meRIP-seq 技术将甲基化DNA 免疫共沉淀(Methylated DNA Immunoprecipitation, MeDIP) 技术、RNA 结合蛋白免疫共沉淀 (RNA immunoprecipitation,RIP) 技术和 RNA 测序 (RNA sequencing,RNA-seq) 技术组合起来,高精度地检测全基因组(或全转录组)范围内的 RNA 甲基化。meRIP-seq 技术采用免疫共沉淀方法,即甲基化 RNA 特异性抗体与被随机打断的 RNA 片段进行孵育,抓取有甲基化修饰的片段进行测序;同时需要平行测序一个对照(control)样本,对照样本用于消除抓取带有甲基化片段过程中的背景。然后将免疫共沉淀(IP)样本和对照样本中的序列片段对比(或定位)到参考基因组/ 转录组上,检测RNA 甲基化位点。对照样本测量对应 RNA 的表达量,本质上是 RNA-seq 数据(见图4)[7]。
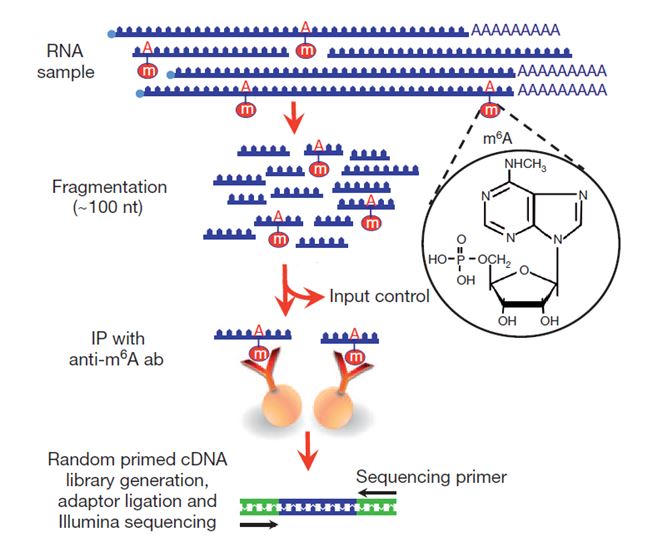
图4 . meRIP-seq 技术检测 m6A 技术流程[4]
实验分组设置:
细胞模型 实验组VS对照组,建议3:3
组织模型 正常组VS疾病组,建议5:5
组内对照:IP组VS in put组*
注*:input组主要用于比较鉴定IP组的抗体特异性结合,是必备的组分
测序模式:PE100/150
测序数据:3-6G
关键分析内容:m6A 的基本特征
m6A修饰基本特征分析主要包括以下三个方面
特征一、peak 在基因元件的分布
本分析主要通过对测序数据比对后,分析相关序列在基因不同原件的分布。主要方法是将5-UTR,CDS,3-UTR 各划分为等长的20个bin,统计peak 落在每个bin 中peak 的百分比。Peak 和bin 的overlap 长度占50%以上就算落在了这个bin上。基因元件分布图见图5、图6:

图5.Peak在元件中的分布曲线图。绿色表示CDS,蓝色表示UTR,灰色的细线表示start-coden的起始位点和stop-coden的终止位点
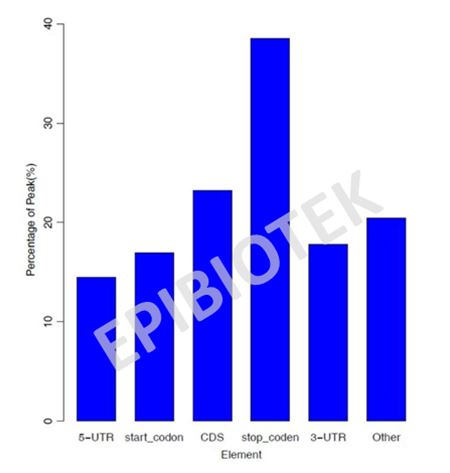
图6. Peak分布条形图,横坐标表示各元件,纵坐标表示落在元件中的peak百分比
特征二、 reads 在基因元件的分布
找到富集区域(peak)后,统计reads 在元件中的分布情况。针对peak,分别提取IP 和Input 在peak 区间的reads,reads 和peak overlap上50%以上就算reads 落在peak 区间,同时normalized IP 和Input 的数据量比例。(见图7)
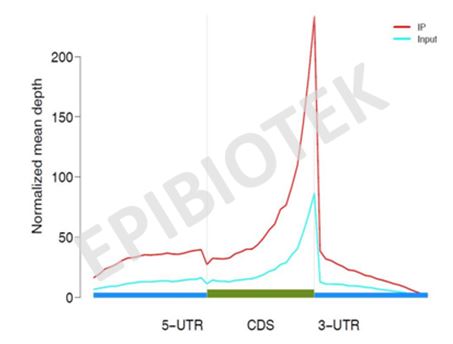
图7. reads 在元件中的分布曲线图。绿色表示 CDS,蓝色表示 UTR,,纵坐标表示 normalized 后的覆盖深度
特征三、Peak 关联基因的特征
针对Peak 关联上的基因,看它的stop-coden、start-coden 是否有m6A 富集区域(peak),以此将gene 分为4 类:PeakStart (m6A peaks around start codon), PeakStop (m6A peaks around stop codon), PeakBoth (m6A peaks around both start and stop codons) and others。
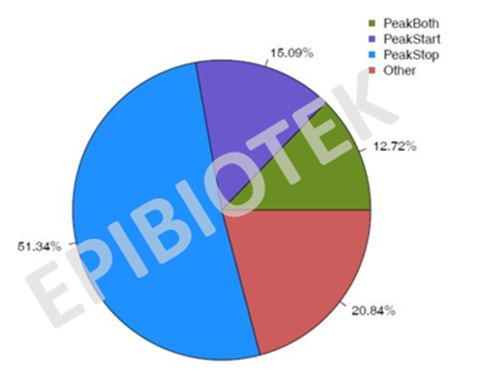
图8. peak关联基因特征pie图
两样品peak overlap 占50%以上则定义为common peak,其他的定义为special peak。共有和特有peak 的韦恩图如下(见图9):

图9. 两样本 peak 韦恩图
通过以上的m6A特征分析,后续的重要分析还包括针对差异peak 来分析关联的基因,以及对这些基因进行GO和KEGG分析。其次,还可以针对目前最新的研究热点,对peak进行circRNA分析,有利于指导环状RNA翻译功能的研究工作[1] 。
另外,通过和同组样本转录组测序数据的联合分析,可以进一步深挖m6A修饰对可变剪切、RNA编辑、RNA表达丰度、miRNA加工生成等方面的影响;也可以结合蛋白质谱定量检测,研究m6A修饰与蛋白质翻译的关系,指导进一步的深入功能机制研究。
自2011年何川教授发表FTO作为m6A去甲基化酶[8]的研究工作以来,m6A的研究深度和广大快速发展。为了帮助国内生物医学特别是肿瘤领域的科研人员更好的理清m6A的研究思路,表观生物制定以下疾病相关m6A研究策略以供参考。

研究案例:FTO通过RNA修饰机制发挥促癌作用
2017年1月,辛辛那提大学研究人员在Cancer Cell 杂志发表论文[9] ,报道了发现肥胖相关蛋白FTO能够通过RNA修饰机制调节一系列基因的表达,发挥重要的促癌作用,导致白血病细胞增多并抑制癌细胞对药物的应答。
研究人员利用100个人类急性髓系白血病(AML)样本以及9个正常对照样本的芯片数据,还对其他一些大规模AML 样本数据进行了分析。他们发现FTO在不同亚型的白血病样本中都存在高表达。(见图10)
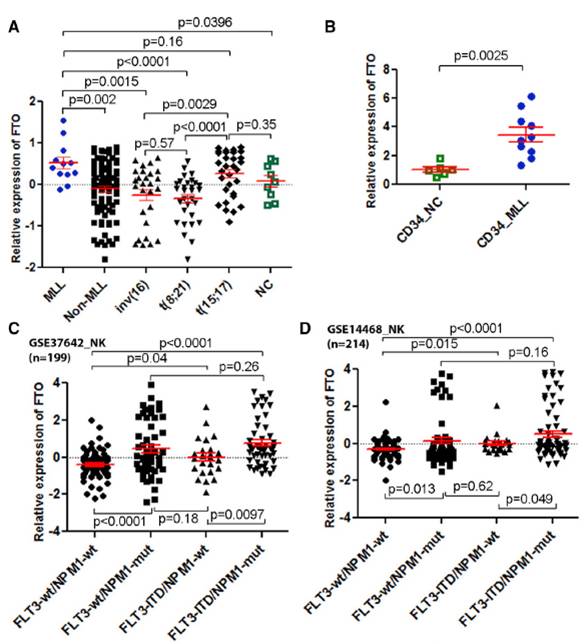
图.10 FTO基因在AML样本中存在高表达
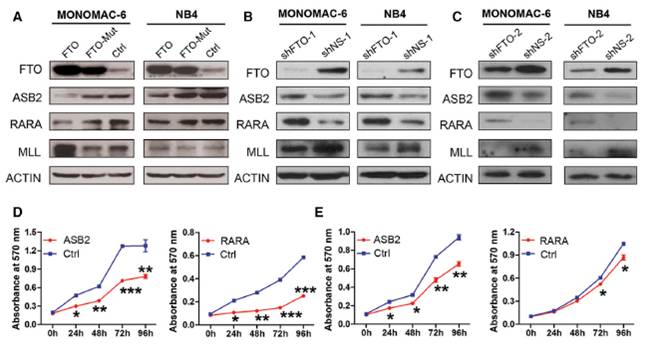
图11. FTO靶向调控ASB2和RARA等抑制白血病细胞生长的基因,通过去甲基化修饰后,反向抑制ASB2和RARA的功能
实验证明FTO靶向调控ASB2和RARA等抑制白血病细胞生长的基因,通过去甲基化修饰后,导致靶mRNA稳定性提高,也相应提高了蛋白质含量,这个结果与之前认为的m6A导致mRNA稳定性下降的结论出现了相反。另外通过沉默m6A的识别蛋白YTHDF1和YTHDF2,发现只有YTHDF2能影响到ASB2和RARA的mRNA水平,但是对于这两个蛋白的丰度却没有产生作用。提示还有新的调控机制尚待发现。
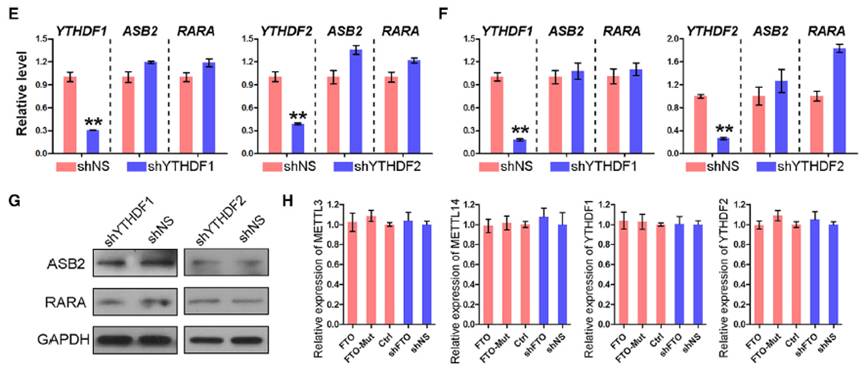
图12. YTHDF2能影响到SB2和RARA的mRNA水平,不能影响蛋白的丰度
文章最后提出了FTO---ABS2/RARA调控轴的机制模型(见图13):由于融合基因等因素的影响如MLL-fusion蛋白等刺激导致FTO表达上升,降低靶基因如ASB2,RARA等的mRNA m6A修饰,抑制其功能发挥,促进了细胞增殖和抑制细胞分化,并且抑制癌细胞对药物的应答。
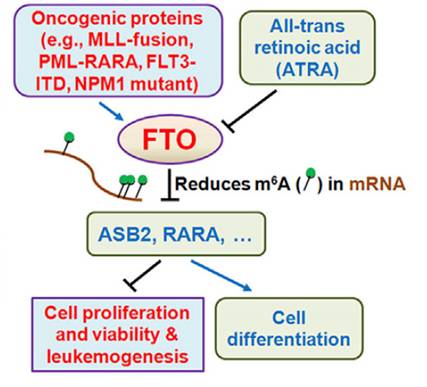
图13.机制模型
本项研究首次证实 m6A 修饰机制在白血病发育和药物应答过程中有重要作用。靶向 FTO 信号途径可能成为治疗白血病的一个新的策略。另外 FTO 也在其他一些实体瘤中发挥促癌作用,因此该研究结果可能对癌症生物学研究和癌症治疗方法的开发有更广泛的影响。
项目链接:RNA甲基化(m6A)免疫共沉淀高通量测序(meRIP-seq)
参考文献:
[1] Zhou C, Molinie B, Daneshvar K, et al. Identification and characterization of m6A circular RNA epitranscriptomes[J]. bioRxiv, 2017: 115899.
[2]Cao G, Li H B, Yin Z, et al. Recent advances in dynamic m6A RNA modification[J]. Open biology, 2016, 6(4): 160003.
[3] Alarcón C R, Goodarzi H, Lee H, et al. HNRNPA2B1 is a mediator of m 6 A-dependent nuclear RNA processing events[J]. Cell, 2015, 162(6): 1299-1308.
[4 ]Li A, Chen Y S, Ping X L, et al. Cytoplasmic m6A reader YTHDF3 promotes mRNA translation[J]. Cell research, 2017.
[5]Yang Y, Fan X, Mao M, et al. Extensive translation of circular RNAs driven by N6-methyladenosine[J]. Cell research, 2017.
[6]Dominissini D, Moshitch-Moshkovitz S, Schwartz S, et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq[J]. Nature, 2012, 485(7397): 201-206.
[7] 刘恋, 张绍武, 孟佳, 等. 高通量 RNA 甲基化测序数据处理与分析研究进展[J]. Progress in Biochemistry and Biophysics, 2015, 42(10): 891-899.
[8] Jia G, Fu Y, Zhao X, et al. N6-methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO[J]. Nature chemical biology, 2011, 7(12): 885-887.
[9] Li Z, Weng H, Su R, et al. FTO plays an oncogenic role in acute myeloid leukemia as a N 6-methyladenosine RNA demethylase[J]. Cancer Cell, 2017, 31(1): 127-141.
- - - 推荐阅读 - - -

【推荐】肿瘤相关超级增强子的研究方案及应用前景
增强子是调控细胞基因时空表达关键的顺式作用元件。2013年,Richard A. Young 实验室基于当时增强子的研究,提出了超级增强子(Super-enhancers, SEs)概念.
2017-06-22

如何快速发现肿瘤特异性外泌体RNA分子标志物
在当前精准医学的大背景下,液体活检作为一项重要的创新技术,有望在癌症早期筛查与诊断、治疗方案指导、疗效评估及预后测评领域发挥作用,具有极高的临床应用价值和市场前
2017-03-16

【冲刺2017NSFC】疾病相关eRNA鉴定及功能验证研究路径
增强子相关RNA(eRNA)是由基因功能元件增强子转录产生的一类长链非编码RNA,在基因转录调控和疾病的发生发展中发挥重要的作用,是近年来非编码RNA领域的新热点。
2017-02-01
