朱冰课题组发现SALL4A蛋白调节增强子上的DNA去甲基化
2016年11月10日,《Molecular Cell》杂志在线发表了题为”Cooperative Action between SALL4A and TET Proteins in Stepwise Oxidation of 5-Methylcytosine”的研究文章,报道了在小鼠胚胎干细胞中,SALL4A蛋白与TET家族双加氧酶共同调节增强子上5-甲基胞嘧啶(5mC)的氧化过程。
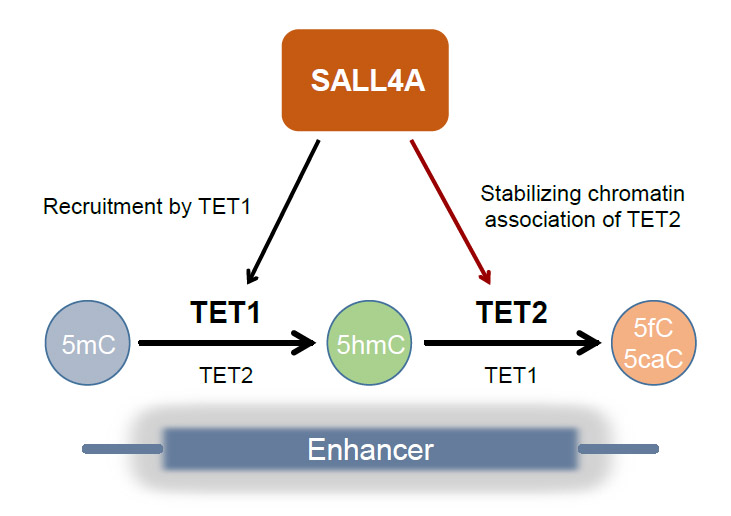
哺乳动物DNA的胞嘧啶甲基化修饰被认为是最稳定的表观遗传修饰,在维持性DNA甲基转移酶的作用下,亲代细胞基因组的DNA甲基化信息经过有丝分裂以半保留复制的方式传递给子代细胞。近年来的研究发现,TET家族蛋白能够将5mC逐步氧化成5-羟甲基胞嘧啶(5hmC)、5-醛基胞嘧啶(5fC)和5-羧基胞嘧啶(5caC),并走向最终的去甲基化。这种动态变化拓展了DNA甲基化所承载的表观遗传信息的可塑性。在基因组上,5mC的氧化受到严格地控制,在某些基因组区域,5hmC会稳定存在,而在别的基因组区域5hmC只是进一步氧化和去甲基化的中间体。这一选择性事件的分子基础尚不明朗。
本研究利用稳定同位素标记的细胞培养(SILAC)联合亲和纯化与蛋白质定量质谱技术,发现锌指结构域蛋白SALL4A倾向于结合含有5hmC修饰的DNA。SALL4是早期胚胎发育过程中的一个重要基因,它的突变会导致常染色体显性遗传的Duane-radial ray综合症。Sall4基因敲除的小鼠胚胎在围着床期即停止发育,并很快死亡。本研究发现,在小鼠胚胎干细胞中,SALL4A蛋白主要定位于增强子,其与染色质的结合在很大程度上依赖于TET1蛋白。进一步分析基因组上SALL4A结合位点的胞嘧啶修饰状态发现,这些位点上缺乏稳定的5hmC,却富集了进一步氧化的产物5fC和5caC,提示SALL4A可能促进5hmC的进一步氧化。果然,敲除Sall4导致在原先的SALL4A结合位点上积累较高水平的5hmC,因为敲除Sall4降低了TET2的稳定结合,不利于5hmC的进一步氧化。
这一工作丰富了对TET家族蛋白调控的DNA氧化和去甲基化过程的理解,并提出了5mC的协同性递进氧化概念。促进了对DNA甲基化的动态性及其在胚胎干细胞功能及重编程中作用的理解。
中国科学院生物物理研究所朱冰研究员和张珠强副研究员为本文的共同通讯作者。朱冰课题组的熊俊博士和张珠强副研究员为本文的并列第一作者。同济大学的高绍荣教授和陈嘉瑜博士,北京生命科学研究所的陈涉研究员、丁小军和许雅丽,中国科学院生态环境研究中心的汪海林研究员和黄华博士,中国科学院上海生物化学与细胞生物学研究所的徐国良研究员,日本熊本大学的Ryuichi Nishinakamura教授也参与了本项研究。该研究得到国家自然科学基金委、科技部、中科院战略性先导专项和美国霍华德•休斯医学研究所国际青年科学家项目的资助。
供稿:朱冰课题组

