新型ChIP-Seq技术实现超低细胞数量组蛋白修饰精确检测
受精卵的形成,源自于精卵两种终末分化生殖细胞结合。随后,受精卵内父源和母源基因组要进行广泛的表观遗传重塑,激活胚胎基因组,控制第一次细胞谱系分化,其中就包括非常广泛而重要的组蛋白修饰。
早期研究已发现,大部分组蛋白修饰在胚胎植入前发育过程中就已出现明显变化,一些调节组蛋白修饰的酶的异常表达或缺失会直接影响胚胎正常发育。但植入前胚胎中基因组上组蛋白修饰具体分布与变化机制,以及它们对胚胎基因表达的影响依然未知。
在2016年9月发布的Nature中,同济大学高绍荣教授研究组通过对组蛋白修饰技术ChIP-Seq加以改进,第一次系统检测了小鼠植入前胚胎发育各个时期全基因组范围内H3K4me3和H3K27me3两种重要组蛋白修饰分布与变化。
ChIP-Seq是一种将染色质免疫共沉淀与二代测序技术结合起来的组蛋白修饰检测技术。这种技术首先利用特定组蛋白修饰抗体将此类组蛋白修饰结合的DNA区域富集,纯化建库后对此区域进行高通量测序。此技术被认为是全基因组范围内研究组蛋白修饰最好的方法。但是传统的ChIP-Seq需要的百万级的细胞数量才能达到检测要求,而植入前胚胎细胞数量远未达到此数量。
为了更高效地从植入前胚胎细胞全基因组范围内富集H3K4me3和H3K27me3两种组蛋白修饰区域,在本项研究中,研究者采用了一种名为ULI-NChIP的技术,结合高通量测序,第一次在103细胞数量级实现了小鼠植入前胚胎细胞发育各个时期内组蛋白H3K4me3及H3K27me3修饰区域检测。分析结果表明,在小鼠植入前胚胎发育的各个时期内,全基因组范围内组蛋白H3K4me3及H3K27me3两种修饰变化规律明显不同。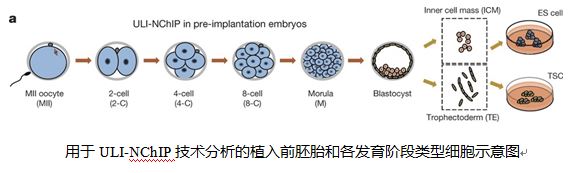
|
|
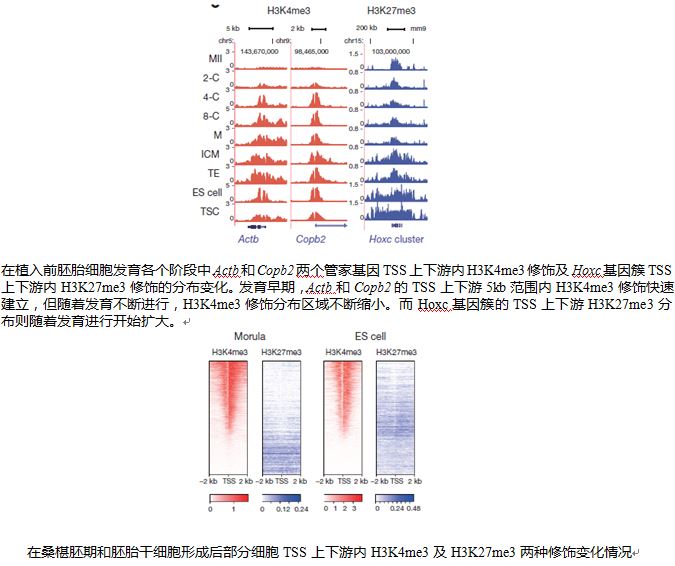
在植入前胚胎发育过程中,H3K4me3修饰的建立更迅速,在早期胚胎细胞基因组中,H3K4me3修饰在一些发育相关基因转录起始位点(Transcriptional Start Site, TSS)附近区域有大范围分布,一般能达到TSS上下游5kb。但随着胚胎细胞的不断发育,H3K4me3修饰的分布范围会以较为稳定的速度慢慢缩小,但不会快速建立或消失。这种较为稳定的变化方式可以保证胚胎发育早期基因表达稳定。最终当胚胎细胞分化为细胞系时,H3K4me3修饰分布范围会缩小到一个很小的范围。而在这个过程中,某些基因TSS上下游H3K27me3修饰分布则开始逐渐增加,对这些基因表达产生影响。这些结果表明,在植入前胚胎发育早期,H3K4me3修饰是细胞调节基因表达的重要途径,通过基因TSS附近H3K4me3的分布区域变化调节基因表达,控制胚胎细胞的分化发育。随着发育不断进行,H3K27me3等其他基因表达调控方式也将逐渐出现,H3K4me3调节作用将逐渐下降。
为了进一步的分析控制H3K4me3修饰的机制,研究者利用siRNA选择性地沉默了多个组蛋白去甲基化酶基因,发现其中Kdm5b对H3K4me3修饰范围起到直接调控功能,Kdm5b被沉默会导致基因组上H3K4me3修饰区域普遍扩展,胚胎发育受到阻滞。
|
|
借助对ChIP技术的改进,该研究成果成功实现了超低细胞数量的组蛋白H3K4me3及H3K27me3修饰检测,第一次建立起了小鼠植入前胚胎发育过程中的组蛋白H3K4me3和H3K27me3修饰图谱,揭示了植入前胚胎发育特殊的表观遗传调控机制,进一步研究植入前胚胎发育以及早期细胞分化的表观遗传调控机制打开了一扇大门。
ULI-NChIP
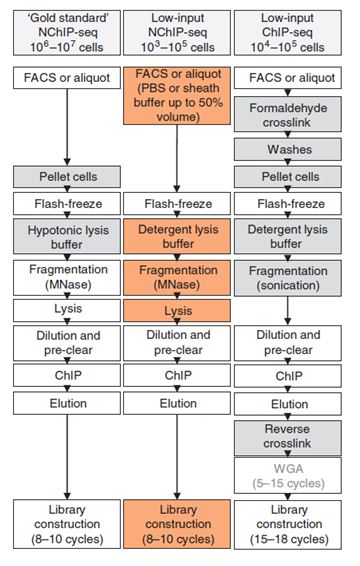
ULI-NChIP技术流程图
相关文献:
Liu X, Wang C, Liu W, et al. Distinct features of H3K4me3 and H3K27me3 chromatin domains in pre-implantation embryos[J]. Nature, 2016.
Brind’Amour J, Liu S, Hudson M, et al. An ultra-low-input native ChIP-seq protocol for genome-wide profiling of rare cell populations[J]. Nature communications, 2015, 6.

