GlycoRNA-seq:糖基化RNA测序,挖掘多类型、特殊修饰非编码小RNA

项目简介
GlycoRNA(糖基化RNA)是2021年斯坦福大学Bertozzi和Flynn教授团队发现的一种全新的RNA修饰形式。GlycoRNA主要存在细胞表面,其包含多种非编码小RNA(sncRNA),如YRNA、snRNA、sno RNA、小tRNA和小rRNA等小RNA,这些小RNA带有N-glycans的复杂糖链修饰[1]。GlycoRNA已被证实参与免疫调控等重要生物学过程,如发现GlycoRNA可介导中性粒细胞的迁移,从而抵抗感染[2]。
表观生物率先推出GlycoRNA-seq糖基化RNA修饰测序服务,为科研同仁提供前沿研究的解决方案。GlycoRNA-seq采用Ac4ManNAz标记和点击化学法,或最新的rPAL法[3],高效富集GlycoRNA,并结合专业的PANDORA-seq[4],检测到更多类型的、带有特殊糖修饰的sncRNA,助力您深入探索GlycoRNA的奥秘,开拓RNA修饰研究的新领域!
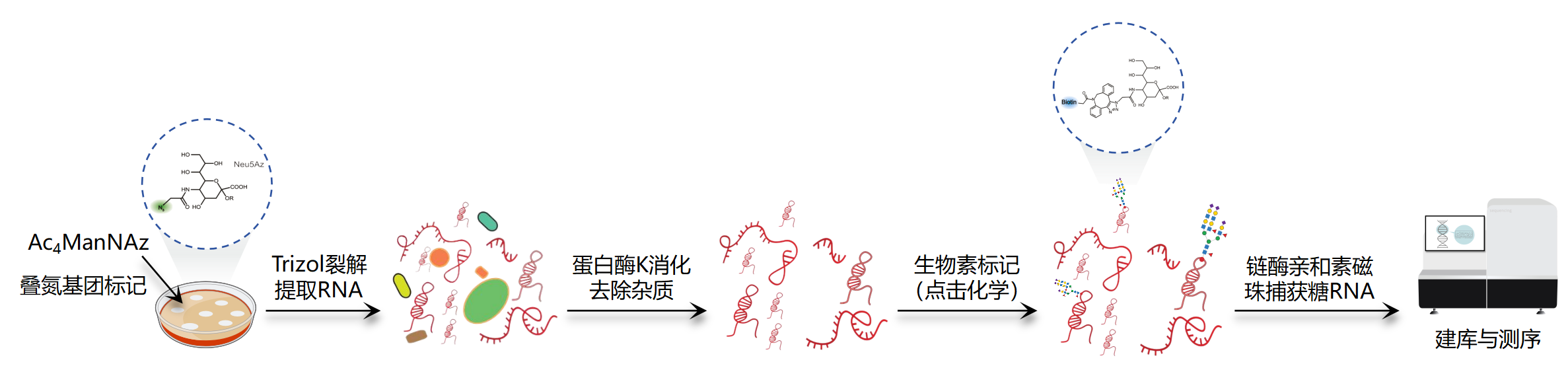
图1. 基于Ac4ManNAz方法的技术步骤[1,2] (注:依赖细胞的代谢活性,适合活细胞样本,不适用组织样本)
技术原理
客户自行选择使用Ac4ManNAz方法或rPAL方法
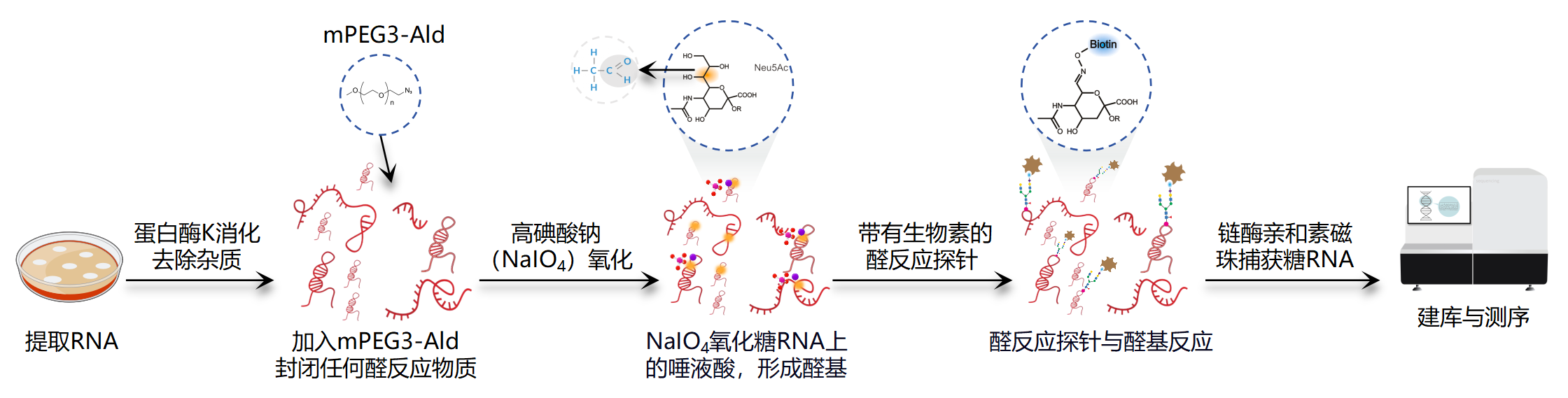
图2. 基于rPAL方法的技术步骤[3] (注:样本类型适用性更广,捕获效率更高)
技术优势
1. 能检测低丰度的GlycoRNA,提供全面、更精细GlycoRNA图谱
2. 同时获取多类型的、带有特殊糖修饰的sncRNA
3. 分析信息丰富,包括序列信息、各类sncRNA表达差异分析等。也可结合质谱分析,推测GlycoRNA上聚糖的类型和结构、不同样本间聚糖组成的差异等
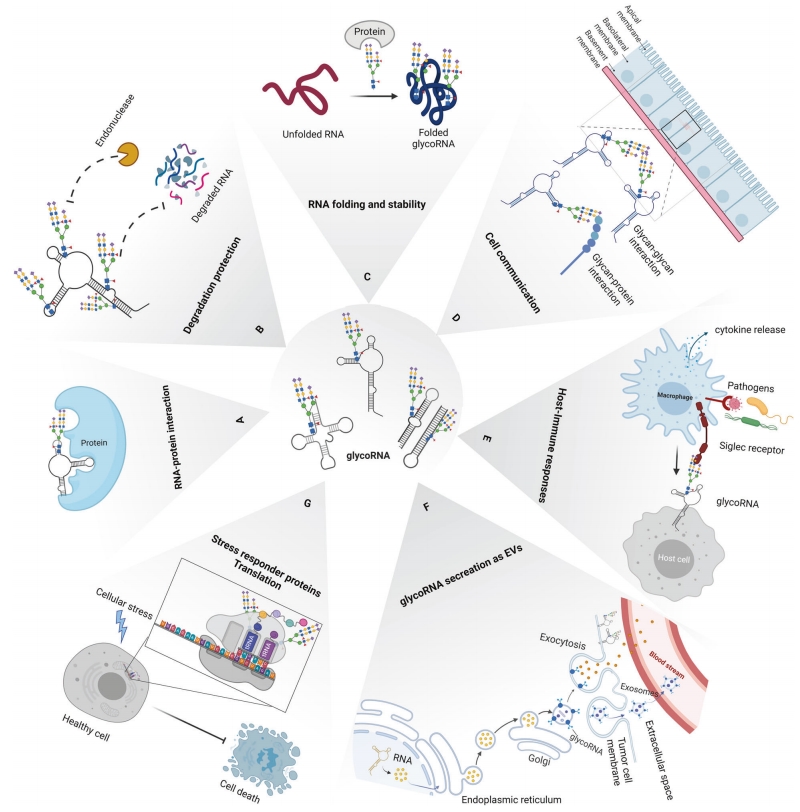
技术应用
1. 研究GlycoRNA在不同物种、组织和细胞中的表达谱和功能差异或修饰模式
2. 研究GlycoRNA的调控机制,探索其与其他分子的相互作用
3. 研究药物对GlycoRNA表达和修饰的影响,开发基于GlycoRNA的新型药物
4. 研究GlycoRNA的生物发生通路或者是糖基化RNA在细胞通讯和细胞间相互作用中发挥的作用
5. 研究与疾病相关的GlycoRNA生物标志物,探索潜在靶点
6. 联合应用质谱分析,检测翻译后修饰;鉴定聚糖类型、组分;糖RNA位点;蛋白质糖基化修饰等。全面分析 GlycoRNA 的表达、修饰和功能
送样要求
捕获方法二选一(Ac4ManNAz或rPAL)
1. 细胞:
Ac4ManNAz方法:≥3×106个细胞
rPAL方法:≥2×106个细胞
2. 组织:
提供 RNA later 处理的组织,≥0.2 cm(仅适用rPAL法;25 mg 组织大约可以提取30 μg总RNA)
3. 全血:
建议≥5 mL,最少3 mL
4. RNA:
Ac4ManNAz方法:≥50 μg(已标记Ac4ManNAz)
rPAL方法:≥30 μg
5.实验设计至少 2 vs 2,优先 3 vs 3 或更多 replicate
温馨提示:预先配置含有终浓度100 μM Ac4ManNAz的培养基,参考文献[1]或者详询技术支持。详细送样要求、所需样本量及其预处理方案请详询。
分析内容
基本分析
1. 原始reads过滤,质量控制
2. 基因组比对
3. 非编码RNA database比对(tRNA、rRNA等)
4. sncRNA长度及分类统计
5. 各类sncRNA定量分析
6. 各类sncRNA表达差异分析(tsRNA、rsRNA、piRNA等)
7. 差异表达sncRNA聚类分析(仅限生物学重复)
高级分析
1. 客户自选不多于50个sncRNA进行分析
2. 靶基因预测
3. 靶基因GO分析
4. 靶基因KEGG分析
案例
Cell:中性粒细胞招募的关键介质“糖基化RNA”[2]
这篇文章探讨了GlycoRNA在小鼠中调控中性粒细胞招募的功能。研究表明,GlycoRNA主要存在于中性粒细胞上,对其向炎症部位的迁移至关重要。中性粒细胞的GlycoRNA通过与内皮细胞上的P-selectin结合,促进了中性粒细胞的粘附和迁移。研究发现,Sidt基因家族对GlycoRNA的表达和功能至关重要,缺失这些基因会显著降低中性粒细胞的招募能力。此外,还揭示了GlycoRNA的生物学重要性,强调了RNA介导的细胞功能的新维度。通过进一步实验,证实了GlycoRNA在中性粒细胞与内皮细胞互作中的关键作用。
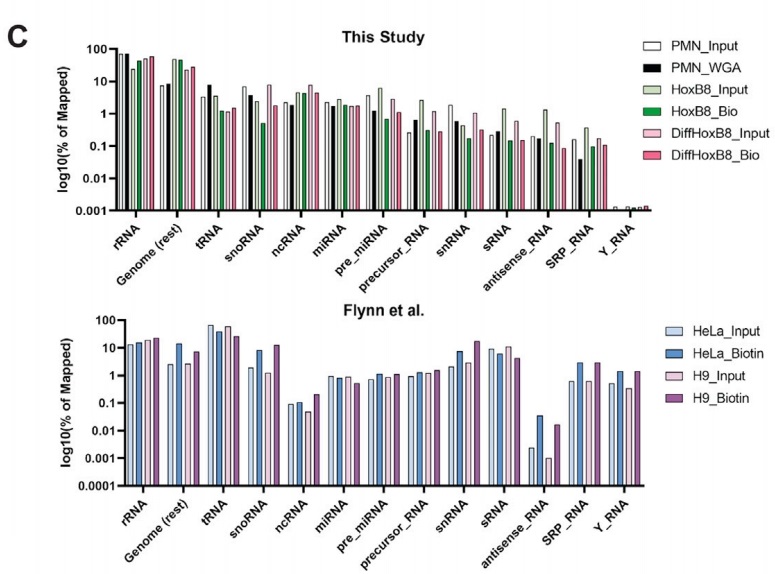
图3. 不同细胞类型中GlycoRNA的种类
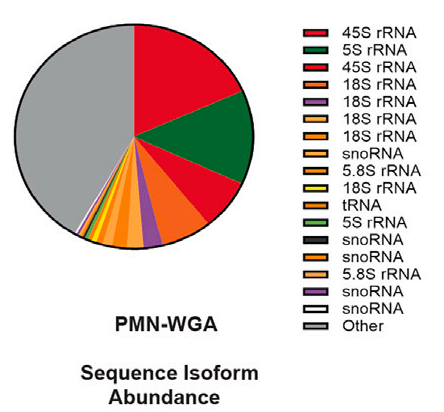
图2. GlycoRNA isoform来源占比饼图
参考文献
[1] Flynn RA, Pedram K, Malaker SA, et al. Small RNAs are modified with N-glycans and displayed on the surface of living cells. Cell. 2021;184(12):3109-3124.e22.
[2] Zhang N, Tang W, Torres L, et al. Cell surface RNAs control neutrophil recruitment. Cell. 2024;187(4):846-860.e17.
[3] Xie Y, Chai P, Till NA, et al. The modified RNA base acp3U is an attachment site for N-glycans in glycoRNA. Cell. 2024;187(19):5228-5237.e12.
[4] Shi J, Zhang Y, Tan D, et al. PANDORA-seq expands the repertoire of regulatory small RNAs by overcoming RNA modifications . Nat Cell Biol. 2021;23(4):424-436.
